Thông tin thuốc tháng 4/2017
Nội dung: Cảnh giác dược
1. Một số tin đáng chú ý trong tạp chí Prescriber Update số tháng 12/2016 (Volume 37, Number 4)
2. HSA cảnh báo về nguy cơ bong võng mạc liên quan đến kháng sinh fluoroquinolon
3. EMA: Mở rộng chỉ định metformin trong điều trị tiểu đường cho bệnh nhân suy giảm chức năng thận mức độ trung bình
4. US.FDA: Cảnh báo mới về việc sử dụng thuốc gây mê toàn thân và thuốc an thần cho trẻ nhỏ và phụ nữ có thai
1. Một số tin đáng chú ý trong tạp chí Prescriber Update số tháng 12/2016 (Volume 37, Number 4)
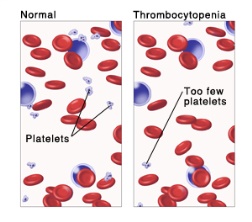
1.1. Nguy cơ giảm tiểu cầu khi sử dụng heparin: Đây là một phản ứng có hại qua trung gian kháng thể tuy hiếm gặp nhưng có khả năng gây tử vong. Tỷ lệ xuất hiện và tử vong do phản ứng này có thể giảm thiểu bằng cách phát hiện sớm, ngừng heparin và điều trị bằng các thuốc chống đông khác. Cân nhắc nguy cơ giảm tiểu cầu liên quan đến sử dụng heparin ở bệnh nhân có giảm tiểu cầu khởi phát sớm, huyết khối hoặc xảy ra phản ứng phản vệ trong hoặc sau khi điều trị bằng heparin. Nguy cơ này xuất hiện với cả với heparin không phân đoạn và heparin trọng lượng phân tử thấp.
1.2. Da tăng nhạy cảm với ánh sáng liên quan đến việc sử dụng thuốc: Tình trạng này xảy ra khi da hấp thụ bức xạ tia UV, gây ra những biến đổi về mặt hóa học của thuốc có trên da, dẫn đến phản ứng độc với ánh sáng (phototoxic) hoặc dị ứng với ánh sáng (photoallergic reaction). Phản ứng độc với ánh sáng thường gặp hơn phản ứng dị ứng với ánh sáng. Phản ứng độc với ánh sáng thường xảy ra do sự phá hủy tế bào do thuốc bị biến đổi ở vùng da tiếp xúc với ánh sáng mặt trời. Các phản ứng này thường phụ thuộc liều và xuất hiện trong vòng vài phút đến vài giờ sau khi tiếp xúc với ánh sáng. Tình trạng tăng sắc tố da cũng được báo cáo. Trong khi đó, phản ứng dị ứng với ánh sáng thường liên quan đến cơ chế miễn dịch. Phản ứng này thường khởi phát muộn, sau 24 - 72 giờ. Bệnh nhân có xuất hiện da tăng nhạy cảm với ánh sáng, cần ngừng dùng thuốc và tránh tiếp xúc với ánh sáng trong giai đoạn điều trị còn lại. Tùy thuộc vào mức độ nặng của phản ứng, có thể sử dụng các corticosteorid theo đường toàn thân hoặc tại chỗ để giảm triệu chứng. Một số thuốc gây tăng nhạy cảm với ánh sáng thường được báo cáo ở New Zealand bao gồm: Doxycyclin, hydrochlorothiazid, amilorid, amiodaron, clorpromazin, trimethoprim, co-trimoxazol, tetracyclin, bendrofluazid, enalapril.
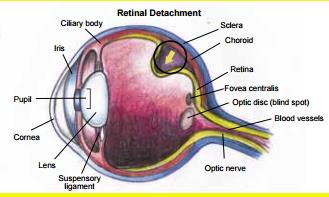
Dựa trên những dữ liệu hiện có, EMA và Health Canada cho rằng không thể loại trừ mối liên quan giữa fluoroquinolon và biến cố bong võng mạc. Do mức độ nghiêm trọng của biến cố, cả hai cơ quan này đều khuyến cáo tờ hướng dẫn sử dụng thuốc cần nhấn mạnh khuyến cáo bệnh nhân thông báo ngay cho cán bộ y tế nếu gặp phải các vấn đề về thị lực khi sử dụng fluoroquinolon đường uống. Tại Singapore, tuy HSA chưa ghi nhận báo cáo bong võng mạc liên quan đến fluoroquinolon nhưng đã ghi nhận một số báo cáo về rối loạn thị lực như nhìn mờ, đỏ mắt, ngứa mắt và viêm kết mạc. HSA hiện đang làm việc với các công ty để bổ sung cảnh báo này vào tờ hướng dẫn sử dụng của các thuốc chứa fluoroquinolon.
3. Kết luận của Ủy ban các Sản phẩm thuốc sử dụng cho người (CHMP) về chế phẩm metformin
Tháng 10/2016, CHMP đã kết luận các chế phẩm có chứa metformin hiện có thể được sử dụng cho bệnh nhân mắc bệnh đái tháo đường typ 2 có biểu hiện suy thận mạn mức độ trung bình. Khuyến cáo này là kết quả sau khi CHMP đã rà soát các dữ liệu khoa học hiện có. Ngoài ra, báo cáo cuối cùng cũng kết luận không cần có chống chỉ định sử dụng thuốc trên những bệnh nhân này.
Thông tin cho bệnh nhân
- Metformin được sử dụng đơn độc hoặc phối hợp với các thuốc khác, kết hợp với chế độ ăn uống và luyện tập để điều trị bệnh đái tháo đường typ 2.
- Trước đây, metformin không được khuyến cáo cho bệnh nhân có suy giảm chức năng thận từ trung bình đến nặng. Khuyến cáo này hiện đã được thay đổi để cho phép sử dụng thuốc trên bệnh nhân có suy giảm chức năng thận mức độ trung bình (mức lọc cầu thận từ 30-59 mL/phút). Liều dùng của metformin cần được điều chỉnh phù hợp với chức năng thận của bệnh nhân và không nên dùng metformin cho bệnh nhân suy thận nặng (mức lọc cầu thận dưới 30 mL/phút).
- Bệnh nhân có suy giảm chức năng thận có thể tăng nguy cơ gặp nhiễm toan lactic, một phản ứng có hại hiếm gặp nhưng nghiêm trọng gây ra bởi metformin do nồng độ acid lactic trong máu tăng cao.
- Tình trạng mất nước (mất một lượng đáng kể thể dịch) làm gia tăng nguy cơ xuất hiện nhiễm toan lactic. Khi bệnh nhân nôn nhiều, tiêu chảy hoặc sốt, tiếp xúc với nhiệt độ cao hoặc khi uống ít nước hơn bình thường thì đều có thể dẫn tới mất nước. Khi đó, cần ngừng dùng metformin trong một thời gian ngắn và báo cho bác sỹ để xử trí.
Thông tin cho cán bộ y tế
- EMA đã kết luận metformin hiện có thể sử dụng cho bệnh nhân có suy giảm chức năng thận mức độ trung bình (GFR từ 30-59 mL/phút). Chống chỉ định metformin cho bệnh nhân có GFR dưới 30 mL/phút. Nên được đánh giá GFR trước khi bắt đầu điều trị và ít nhất 1 năm 1 lần sau đó.
- Nên cân nhắc giảm liều cho bệnh nhân có suy giảm chức năng thận mức độ trung bình theo các mức liều khuyến cáo và các yếu tố nguy cơ gây nhiễm toan lactic cần được đánh giá trước và trong quá trình sử dụng thuốc của bệnh nhân.
- Không khuyến cáo sử dụng các chế phẩm phối hợp cố định liều có chứa metformin cho bệnh nhân bị suy giảm chức năng thận mức độ trung bình vì những hoạt chất còn lại trong công thức phối hợp có thể không phù hợp với bệnh nhân.
- Khi sử dụng các chế phẩm phối hợp cố định liều này cho bệnh nhân có suy giảm chức năng thận, dựa trên những giới hạn kê đơn và hiệu quả với các hoạt chất khác trong công thức, cần cân nhắc hiệu chỉnh mức liều phù hợp hoặc chuyển sang sử dụng các viên đơn thành phần.
- Các khuyến cáo mới nhất về việc sử dụng metformin cho bệnh nhân có suy giảm chức năng thận mức độ trung bình và cảnh báo thận trọng với nhiễm toan lactic sẽ được cập nhật thống nhất trong tờ thông tin sản phẩm trên toàn châu Âu.
4. Thông báo về sử dụng thuốc gây mê toàn thân và thuốc an thần khi tiến hành phẫu thuật và thủ thuật
Ngày 13/12/2016, Cơ quan Quản lý Thuốc và Thực phẩm Hoa Kỳ (US.FDA) thông báo về việc sử dụng thuốc gây mê toàn thân và thuốc an thần khi tiến hành phẫu thuật và thủ thuật ở trẻ nhỏ dưới 3 tuổi và phụ nữ mang thai ở 3 tháng cuối có liên quan đến sự phát triển não bộ của trẻ.
Tương tự như các nghiên cứu trên động vật, nghiên cứu trên người gần đây cho thấy sử dụng đơn liều, thời gian ngắn thuốc gây mê toàn thân và thuốc an thần đối với trẻ sơ sinh hoặc trẻ nhỏ dường như không gây ảnh hưởng tiêu cực đến hành vi hoặc khả năng học hành. Tuy nhiên, cần có thêm nghiên cứu mô tả ảnh hưởng của việc sử dụng các thuốc này lên sự phát triển não bộ của trẻ khi trẻ phơi nhiễm với các thuốc này sớm trong những năm đầu đời.
Nhằm tăng cường truyền thông đến cộng đồng về nguy cơ tiềm tàng này, US. FDA yêu cầu cảnh báo này cần được thêm vào các nhãn thuốc và tờ Hướng dẫn sử dụng của các thuốc gây mê và an thần đang lưu hành trên thị trường. US. FDA sẽ tiếp tục giám sát việc sử dụng các loại thuốc này ở trẻ em và phụ nữ mang thai và sẽ cập nhật tới cộng đồng nếu có thêm thông tin mới.
Thuốc gây mê và thuốc an thần cần thiết cho trẻ sơ sinh, trẻ em và phụ nữ mang thai trong trường hợp cần tiến hành phẫu thuật hoặc thủ thuật khác gây đau và stress, đặc biệt trong trường hợp đe dọa tính mạng và không thể trì hoãn phẫu thuật. Ngoài ra, việc không điều trị giảm đau có thể gây hại cho trẻ và ảnh hưởng tới hệ thống thần kinh đang phát triển của trẻ.
Khuyến cáo cho cán bộ y tế: Cần đánh giá cân bằng nguy cơ -lợi ích khi sử dụng thuốc gây mê trên trẻ nhỏ và phụ nữ mang thai, đặc biệt khi tiến hành các thủ thuật can thiệp kéo dài hơn 3 giờ hoặc tiến hành nhiều thủ thuật trên trẻ em dưới 3 tuổi. Cần phải trao đổi trước với cha mẹ, người chăm sóc của trẻ và bản thân phụ nữ mang thai về những lợi ích, rủi ro, và thời gian thích hợp tiến hành phẫu thuật có thể bị trễ lại mà không gây ảnh hưởng đến sức khỏe của trẻ.
Nguồn:
- http://www.medsafe.govt.nz/profs/PUarticles.asp
- http://www.hsa.gov.sg/content/dam/hsa/hprg
- http://ansm.sante.fr/S-informer/Travaux-de-l-Agence-Europeenne-des-Medicaments-EMA-Comite-des-medicaments-a-usage-humain-CHMP/Avis-favorable-pour-l-octroi-d-une-AMM-pour-pour-huit-nouveaux-medicaments-retour-sur-la-reunion-d-octobre-2016-du-CHMP-Point-d-Information
http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Metformin_and_metformin-containing_medicines/human_referral_000397.jsp&mid=WC0b01ac05805c516f
- http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalProducts/ucm533195.htm



