Thông tin thuốc tháng 02/2013: Tổng kết báo cáo phản ứng có hại của thuốc năm 2012
DS. Đặng Thị Thuận Thảo
Khoa Dược - BV Từ Dũ
Báo cáo phản ứng có hại của thuốc (ADR ) tự nguyện gồm các phần thông tin về bệnh nhân (tuổi, giới, cân nặng, chiều cao, địa chỉ,…); thông tin về thuốc nghi ngờ gây ADR (tên thuốc, hàm lượng nồng độ, lý do dùng thuốc,…); thông tin về các thuốc dùng đồng thời và bệnh sử; thông tin về cách xử trí ADR; thông tin về người báo cáo (tên, địa chỉ, chuyên môn, ngày báo cáo, đơn vị báo cáo,…).
ADR được phân loại theo 6 cấp độ theo thang phân loại của WHO: chắc chắn (certain); có khả năng (probable/likely), có thể (possible), không chắc chắn (unlikely), không phân loại được (conditional/unclassified), không thể đánh giá hay phân loại được (unassessable/ unclasifiable), cùng với ý kiến của chuyên gia thẩm định.
Theo thống kê trung tâm Uppsala nhận được khoảng 300.000 báo cáo mỗi năm từ các quốc gia thành viên.
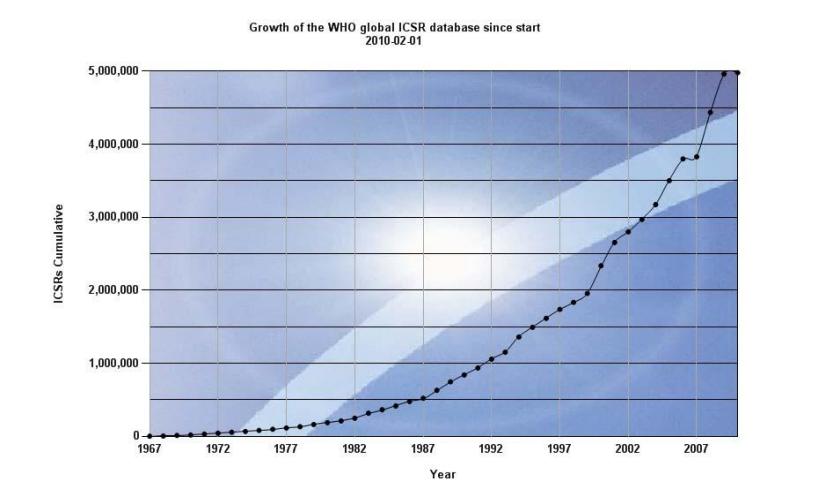
Hình 1.2: Sự gia tăng của cơ sở dữ liệu toàn cầu về báo cáo tự nguyện (số liệu tính đến tháng 2 năm 2010)
I. Tổng kết báo cáo ADR năm 2012
Từ tháng 1/2010, theo phân công của Bộ Y tế, Trung tâm Thông tin thuốc và Phản ứng có hại của thuốc (DI&ADR) quốc gia là đầu mối tiếp nhận báo cáo ADR từ tất cả các cơ sở khám bệnh và chữa bệnh, từ cán bộ y tế và các đơn vị sản xuất kinh doanh dược phẩm trên phạm vi toàn quốc.
Từ tháng 8/2011, Trung tâm Thông tin thuốc và Phản ứng có hại của thuốc (DI&ADR)
khu vực phía Nam (Thành phố Hồ Chí Minh) được thành lập tại Bệnh viện Chợ Rẫy và bước đầu thu nhận báo cáo từ các cơ sở điều trị, các đơn vị sản xuất kinh doanh dược phẩm của các tỉnh, thành phố từ Ðà Nẵng trở vào.
1. Số lượng báo cáo đã thu nhận
Trung tâm DI&ADR Quốc Gia
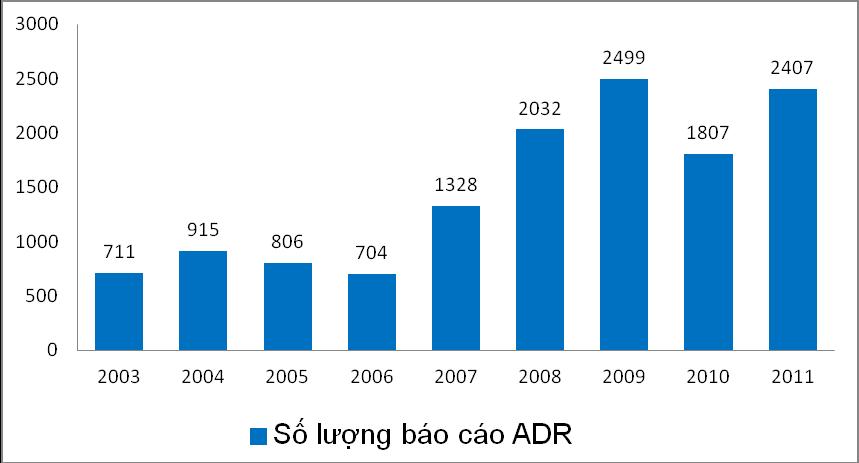
Năm 2011, số lượng báo cáo tiếp nhận được đã tăng trở lại với tổng số báo cáo là 2.407 báo cáo. Trong đó, số lượng báo cáo ADR nhận được phân bố không đều giữa các tháng, ít nhất vào tháng 2 (45 báo cáo) và nhiều nhất vào tháng 11 (535 báo cáo).
Số lượng báo cáo thấp, tỷ lệ báo cáo cao nhất năm 2009 là 30 báo cáo/1 triệu dân (tiêu chuẩn của WHO: 200 báo cáo/1 triệu dân)
Chất lượng báo cáo còn kém: báo cáo thiếu thông tin; thông tin ghi trên báo cáo chưa rõ ràng, chưa chính xác, mâu thuẫn, mờ, khó đọc...
Trung tâm DI&ADR TPHCM
Năm 2012, Trung tâm đã tiếp nhận 880 báo cáo ADR từ 78 cơ sở y tế phân bố trên 18 tỉnh thành từ miền Nam Trung Bộ trở vào. Ngoài ra, Trung tâm còn tiếp nhận các báo cáo phản ứng thuốc và báo cáo tổng hợp từ 10 đơn vị sản xuất, kinh doanh dược phẩm.
2. Tình hình gửi báo cáo ADR từ các đơn vị
Trung tâm DI&ADR TPHCM
Đơn vị báo cáo
Số lượng báo cáo ADR được ghi nhận chủ yếu từ các bệnh viện miền Nam với 95,57%.
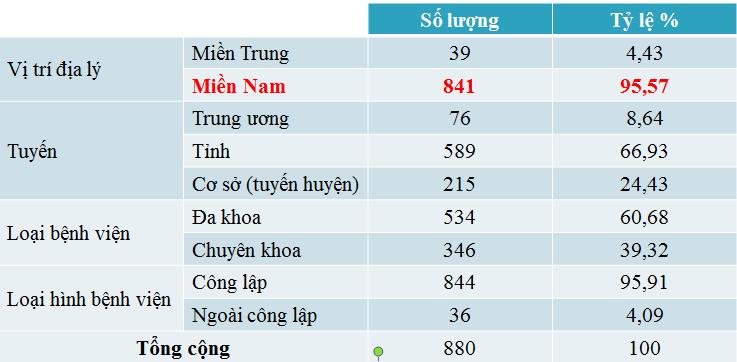
Báo cáo ADR từ sơ sở điều trị: 880 báo cáo, thuộc 78 cơ sở điều trị (18 tỉnh thành phía nam). Tập trung nhiều nhất ở TP.HCM (449 báo cáo), An Giang (159 báo cáo), Cần Thơ (78 báo cáo).
Bệnh viện gửi báo cáo nhiều nhất: BV Phạm Ngọc Thạch (97 báo cáo), BV Từ Dũ (81 báo cáo), BV Nhân Dân Gia Định (66 báo cáo), BV Chợ Rẫy (51 báo cáo), BVĐK thị xã Tân Châu (An Giang) (44 báo cáo).
Chưa ghi nhận báo cáo ADR (13 tỉnh): Bình Định, Bình Phước, Đà Nẵng, Đắk Lắk, Đắk Nông, Gia Lai, Khánh Hòa, Kon Tum, Long An, Phú Yên, Tây Ninh, Tiền Giang và Trà Vinh.
Thông tin về người báo cáo
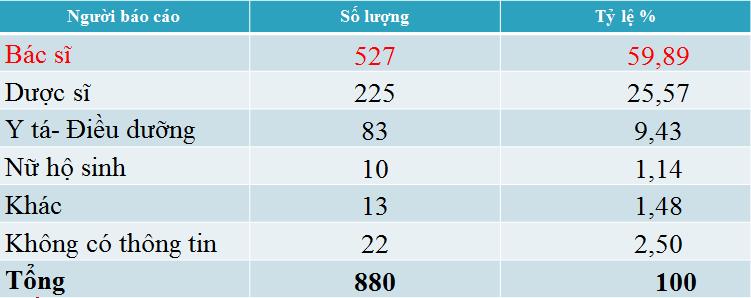
Người báo cáo là các cán bộ và nhân viên y tế. Trong đó, người tham gia báo cáo nhiều nhất là bác sĩ (527 người) chiếm hơn một nửa số lượng người báo cáo (59,89%).
Còn ghi nhận báo cáo thiếu thông tin về người báo cáo (2,5%).
Thông tin bệnh nhân trong các báo cáo ADR
Độ tuổi
Trong năm 2012, các báo cáo ADR tập trung chủ yếu ở nhóm đối tượng trưởng thành từ 18-60 tuổi (chiếm 65,23%), tiếp đến đối tượng người cao tuổi (>60 tuổi) cũng gặp nhiều phản ứng với tỷ lệ 18,75%.
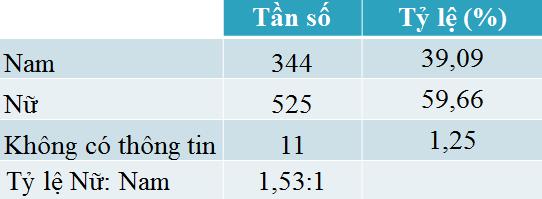
Giới
Nữ chiếm tỷ lệ phản ứng thuốc gấp 1,53 lần so với nam
Thông tin về thuốc nghi ngờ gây ADR
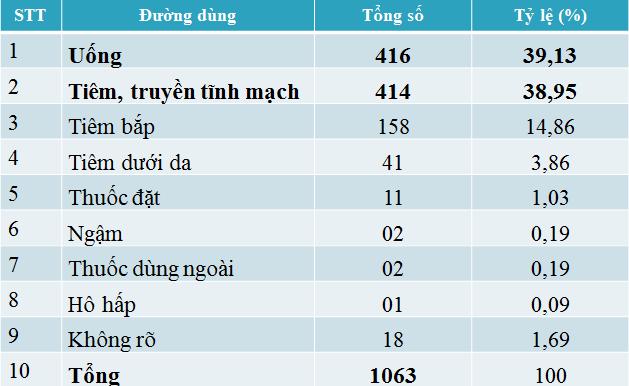
Đường dùng
Hai đường dùng uống và tiêm tĩnh mạch có tỉ lệ báo cáo ADR chiếm tỷ lệ khá cao khoảng 39% cho mỗi đường dùng.
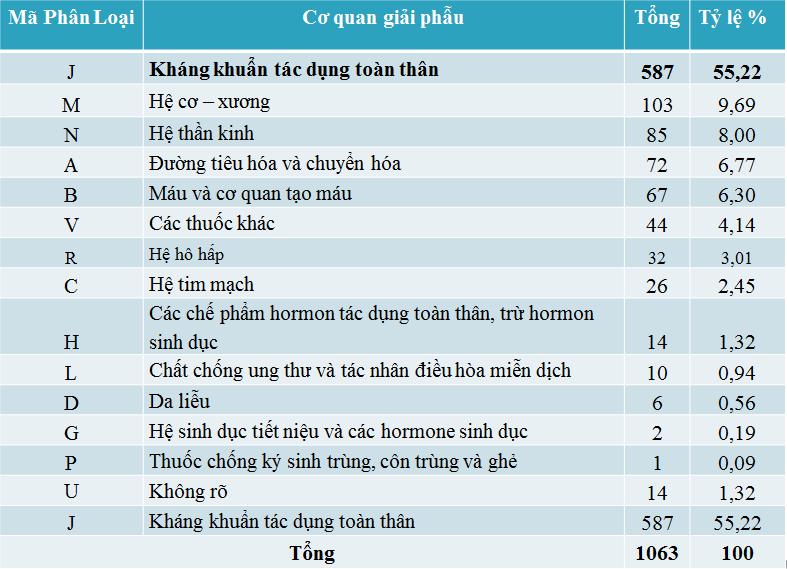
Theo đặc điểm giải phẫu
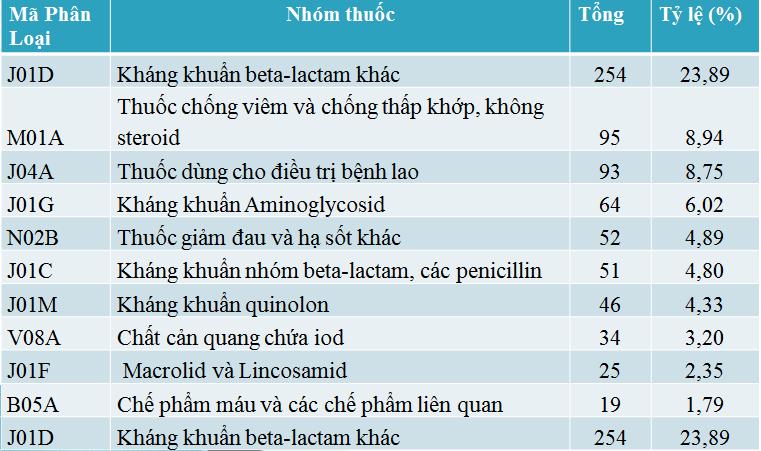
Theo họ dược lý
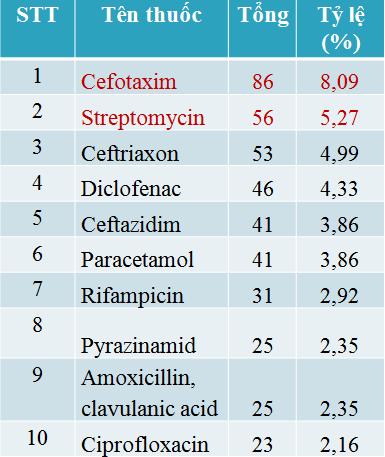
3. Các thuốc nghi ngờ gây ADR được báo cáo nhiều nhất
Các phản ứng thuốc tập trung chủ yếu vào nhóm kháng khuẩn tác dụng toàn thân (587/880 báo cáo) và đây là nhóm thuốc chứa thuốc nghi ngờ phản ứng nhiều nhất đó là Cefotaxim (86 báo cáo) tiếp đến Streptomycin (56 báo cáo).
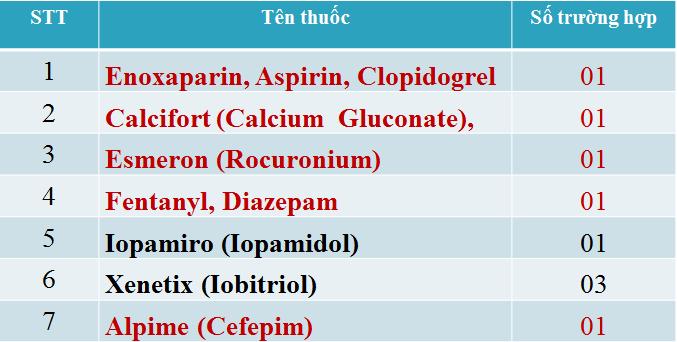
Nổi bật trong năm nay, xảy ra hàng loạt phản ứng thuốc cản quang chứa Iod với số lượng 34 báo cáo. Trong 34 báo cáo này, có 04 báo cáo ghi nhận bệnh nhân tử vong và nặng, xin về sau khi dùng thuốc
4. Báo cáo ADR nghiêm trọng
III. Kết luận
Công tác báo cáo ADR năm 2012 đã có những chuyển biến tích cực hơn, số lượng báo cáo ADR tự nguyện từ các cơ sở khám/chữa bệnh cũng như các đơn vị sản xuất kinh doanh dược phẩm đã tăng trở lại. Tuy nhiên, so với thực tế thì số lượng báo cáo ADR vẫn còn rất thấp, đi kèm đó là chất lượng thông tin của báo cáo chưa cao.
Tình trạng ADR được báo cáo thấp hơn thực tế:
- Làm chậm việc phát hiện tín hiệu ADR.
- Gây ra những đánh giá không đúng mức về tần suất xuất hiện ADR.
Do vậy việc tuyên truyền tập huấn nâng cao nhận thức và cung cấp kỹ năng phát hiện, theo dõi và báo cáo ADR cho cán bộ y tế cần được duy trì và tăng cường.
Tài liệu tham khảo
- Eland IA, Belton KJ, van Grootheest AC, Meiner AP, Rawlins MD, et al. Attitudinal survey of voluntary reporting of adverse drug reactions. Br J Clin Pharmacol 1994; 48: 623-627.
- Tổng kết báo cáo ADR năm 2012 của Bệnh viện Từ Dũ
- Tổng kết báo cáo ADR năm 2011 của Trung Tâm ADR Quốc Gia
- Tổng kết báo cáo ADR năm 2012 của Trung tâm ADR TPHCM



