Khoa Hiếm muộn – BV Từ Dũ
Giới thiệu về chẩn đoán di truyền phôi trước làm tổ
Chẩn đoán di truyền trước làm tổ (PGD – Preimplantation Genetic Diagnosis) là kỹ thuật dùng để xác định các rối loạn về gen di truyền hay bất thường trong bộ nhiễm sắc thể của giao tử hay phôi ở giai đoạn trước khi phôi bám vào nội mạc tử cung để làm tổ. Quá trình chẩn đoán di truyền trước làm tổ bao gồm hai giai đoạn chính là sinh thiết và chẩn đoán di truyền. Bài viết này giới thiệu về các kỹ thuật sinh thiết và ảnh hưởng của sinh thiết lên sự phát triển của phôi cũng như của các em bé ra đời từ kỹ thuật này.
Kỹ thuật sinh thiết trong chẩn đoán di truyền trước làm tổ là gì?
Quá trình thụ tinh trong ống nghiệm (TTTON) bao gồm các giai đoạn kích thích buồng trứng, chọc hút trứng, thụ tinh trứng với tinh trùng, sau đó phôi được nuôi cấy và chuyển vào buồng tử cung người mẹ.
Quá trình sinh thiết để chẩn đoán di truyền trước làm tổ có thể được thực hiện ở 3 giai đoạn khác nhau: sinh thiết trước và ngay sau khi trứng thụ tinh (sinh thiết thể cực thứ nhất và thứ hai), sinh thiết phôi ở giai đoạn phân cắt (ngày thứ 3 sau thụ tinh) hay sinh thiết ở giai đoạn phôi nang (ngày thứ 5 sau thụ tinh). Mỗi giai đoạn sinh thiết đều mang ưu điểm, khuyết điểm cũng như chỉ định riêng. Qui trình sinh thiết chung bao gồm việc sử dụng kính hiển vi đảo ngược được gắn hệ thống vi thao tác để cố định mẫu vật, mở cửa sổ màng zona pellucida, dùng kim sinh thiết để lấy mẫu vật ra khỏi trứng hay phôi. Sau đó trứng hay phôi sẽ tiếp tục được nuôi cấy, mẫu vật được cố định để chẩn đoán di truyền.
Yêu cầu kỹ thuật khi thực hiện sinh thiết
1. Chuẩn bị trước sinh thiết
Các tế bào ngoại lai như tinh trùng, tế bào viền (cumulus cells) cần được làm sạch trước khi sinh thiết nhằm tránh chẩn đoán nhầm DNA của các tế bào này. Do vậy, những bệnh nhân có chỉ định thực hiện chẩn đoán di truyền trước làm tổ cần được thực hiện TTTON bằng phương pháp ICSI (bơm tinh trùng vào bào tương trứng). Danh tính của trứng, phôi và mẫu vật cũng cần được xác định chính xác và kiểm tra ít nhất hai lần ở mỗi khâu trong suốt quá trình thực hiện nhằm đảm bảo kết quả chẩn đoán di truyền của mẫu vật được liên hệ chính xác đến trứng hay phôi tương ứng. Môi trường nuôi cấy và sinh thiết cũng đóng vai trò quan trọng nhằm đảm bảo sự phát triển tiếp theo của phôi. Môi trường sinh thiết giúp quá trình thao tác dễ dàng hơn. Một trong những môi trường quan trọng đó là môi trường không có Ca2+ và Mg2+ (Ca2+ và Mg2+ free medium). Sau đó, phôi cần được nuôi cấy bằng hệ thống chuỗi môi trường tùy thuộc giai đoạn phát triển (ví dụ như hệ thống môi trường G1, G2 (Vitrolife, Sweden) và được nuôi trong tủ cấy 3 loại khí (5% O2, 6% CO2, 89 %N2) nhằm đảm bảo quá trình phát triển tối ưu của phôi.
Vai trò môi trường không có Ca2+ và Mg2+ trong sinh thiết phôi
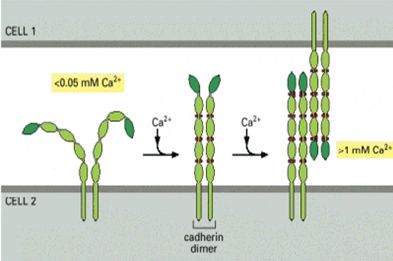
Nhiều nghiên cứu cho thấy quá trình sinh thiết phôi sẽ dễ dàng hơn khi phôi được ủ trong môi trường không có Ca2+ và Mg2+ vài phút trước khi tiến hành sinh thiết. Ca2+ và Mg2+ đóng vài trò quan trọng trong cấu tạo các liên kết ở màng ngoài các phôi bào. Một trong các liên kết này là Cadherin, đã bắt đầu được hình thành khi phôi giai đoạn 6 phôi bào (khoảng ngày thứ 3 sau thụ tinh), để đến ngày thứ 4, tất cả các phôi bào sẽ liên kết và nén chặt lại thành một khối thống nhất (compaction).
Cadherin là protein gồm 2 thành phần: phần bên trong tế bào gắn với khung xương của tế bào và phần bên ngoài tế bào là polypeptid gồm có 5 đồng phân (Hình 1). Các đồng phân này gắn kết với nhau tại các vị trí gắn kết Ca2+ (Ca2+ binding sites) và cũng từ đó gắn kết với các đồng phân cadherin của tế bào lân cận. Nếu môi trường xung quanh tế bào có nồng độ Ca2+ cao thì phần ngoài của chuỗi cadherin sẽ cứng chắc và mất tính đàn hồi. Ngược lại, nếu môi trường xung quanh tế bào có ít Ca2+ thì phần ngoài của chuỗi cadherin sẽ gắn kết lòng lẻo hơn và dễ bị ly giải bởi các men ly giải protein. Kết quả nghiên cứu của Dumoulin và cs (1998) cho thấy thời gian ủ phôi trong môi trường này quá lâu sẽ làm ảnh hưởng đến sự phát triển tiếp theo của phôi. Do vậy, thời gian ủ phôi cần được giới hạn (dưới 10 phút) và phôi cần rửa sạch nhiều lần trước sinh thiết. Ngoài ra, môi trường không có Ca2+ và Mg2+ có chứa sodium lactate, sodium pyruvate, và alanyl-glutamine cho kết quả có thai sau sinh thiết cao hơn một cách đáng kể so với môi trường không có Ca2+ và Mg2+ đơn thuần .
Copyright © 2002 Bruce Alberts, Dennis Bray, Julian Lewis, Martin Raff, Keith Roberts, and James D. Watson
2. Mở cửa sổ màng zona pellucida (zona pellucida opening)
3. Sinh thiết mẫu vật
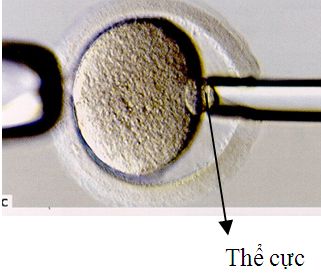 Sinh thiết thể cực | 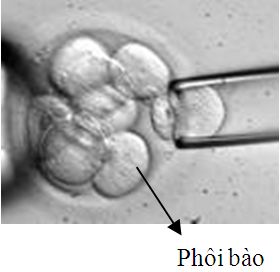 | 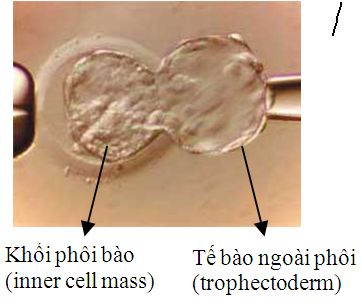 Sinh thiết phôi nang |
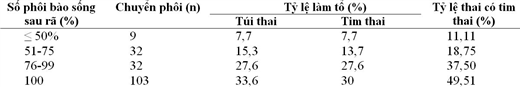
Trong sinh thiết phôi giai đoạn phân cắt, số lượng phôi bào sinh thiết tùy thuộc vào mục đích chẩn đoán di truyền. Ví dụ như sinh thiết 1 phôi bào để chẩn đoán dị bội của một số cặp nhiễm sắc thể (NST) xác định, sinh thiết 2 phôi bào để chẩn đoán các bất thường liên quan đến NST giới tính hay một số bất thường về chuyển đoạn, đảo đoạn NST. Như vậy câu hỏi được đặt ra là sinh thiết 1 hay 2 phôi bào có ảnh hưởng đến sự phát triển của phôi hay không? Thực nghiệm so sánh quá trình phôi bào được lấy ra trong sinh thiết tương đương với phôi bào chết sau khi rã phôi trữ do Cohen và cs (2007) tiến hành cho thấy chu kỳ chuyển phôi sau rã không có phôi bào chết cho tỷ lệ có tim thai là 30% so với chu kỳ chuyển phôi có 25-50% phôi bào chết là 13,7% (Bảng 1). Ngoài ra, một số nghiên cứu cho thấy sinh thiết một phôi bào ít làm giảm khả năng làm tổ của phôi, tuy nhiên sinh thiết hai phôi bào có thể làm giảm hơn 50% khả năng làm tổ của phôi. Và đương nhiên, kỹ năng và kinh nghiệm của người sinh thiết cũng đóng vai trò rất quan trọng.
Hiệu quả chẩn đoán di truyền
Kể từ khi ra đời năm 1990, phương pháp chẩn đoán di truyền trước làm tổ đã được thực hiện tại nhiều trung tâm điều trị hiếm muộn trên thế giới. Kết quả một nghiên cứu đoàn hệ được thực hiện trong vòng 7 năm (1992-2005) đánh giá sức khỏe của các em bé ra đời bằng phương pháp chẩn đoán di truyền trước làm tổ ở phôi ngày thứ 3 sau ICSI cho thấy không có sự khác biệt có ý nghĩa về tỷ lệ đa thai, tuổi thai, cân nặng và tỷ lệ bất thường lớn (major malformation rates) sau sinh của 581 em bé ra đời từ pháp này trong số 2889 em bé ra đời bằng phương pháp ICSI đơn thuần. Tỷ lệ bất thường lớn chung là 2,13 and 3,38% (OR: 0,62 (0,31–1,15)). Tuy nhiên, tỷ lệ trẻ chết chu sinh trong nhóm thực hiện chẩn đoán di truyền trước làm tổ cao hơn nhóm chứng (4.64% so với 1,87% (OR 2,56 (1,54–4,18)). Do vậy, quá trình sinh thiết phôi không phải là yếu tố nguy cơ gây ảnh hưởng tiêu cực đến trẻ sinh ra từ phương pháp này.
Kết luận
Tài liệu tham khảo
2. Hill D, Li M. Embryo biopsy medium and PGD pregnancy rates. Clin Embryol 2004;7:11–2. Inzunza J, Iwarsson E, Fridstrom M, et al. 1998. Application of single-needle blastomere biopsy in human preimplantation genetic diagnosis. Prenat Diagn 18: 1381–1388.
3. Letterie, G.S. (1997) Assisted hatching: Rationale, technique, and clinical outcomes. Assist Reprod, Reviews 8: 116–125.
4. Cohen, J., M. Alikani, J. Trowbridge, Z. Rosenwaks (1992) Implantation nhancement by selective assisted hatching using zona drilling of human embryos with poor prognosis. Hum Reprod 7: 685–691
6. Kenichiro H., Megumi F., Kaori H., Toshitaka H., Tomoyo M., Masayuki K. & Kazuo K. (2008) Effect of the size of zona pellucida opening by laser assisted hatching on clinical outcome of frozen cleaved embryos that were cultured to blastocyst after thawing in women with multiple implantation failures of embryo transfer: a retrospective study. J Assist Reprod Genet, 25, 129-135.
7. Alikani M, Cekleniak N, Walters E, Cohen J. Monozygotic twinning following assisted conception: an analysis of 81 consecutive cases. Hum Reprod. 2003; 18: 1937–1943.
8. Edi-Osagie EC, Hooper L, McGinlay P et al. Effect(s) of assisted hatching on assisted conception (IVF & ICSI). Cochrane Database Syst Rev. 2003; 4: CD001894.
9. Ruangvutilert P, Delhanty JD, Serhal P, Simopoulou M, Rodeck CH, Harper JC. 2000. FISH analysis on day 5 post-insemination of human arrested and blastocyst stage embryos. Prenat Diagn 20: 552–560.
10. Cohen J, Wells D, Munn_e S. Removal of two cells from cleavage stage embryos is likely to reduce the efficacy of chromosomal tests employed to enhance implantation rates. Fertil Steril 2007;87:496–503.
11. Liebaer I., Desmyttere S., Verpoest W., De Rycke M., Staessen C., Sermon K., Devroey P., Haentjens4 P. & Bonduelle M. (2010) Report on a consecutive series of 581 children born after blastomere biopsy for preimplantation genetic diagnosis. Human Reproduction, 25, pp275-282



