BS. Đỗ Minh Hoàng Trọng
Khoa Giải phẫu bệnh – BV Từ Dũ
1. Bệnh nhân:
- Lấy mẫu ở nửa chu kỳ sau của kinh nguyệt để tránh mẫu không bị lẫn nhiều máu. Không lấy mẫu phết cổ tử cung khi đang có kinh.
2. Phiếu xét nghiệm: bắt buộc phải có những thông tin tối thiểu sau:
- Họ và tên
- Năm sinh (hoặc Tuổi)
- PARA
- Ngày lấy mẫu
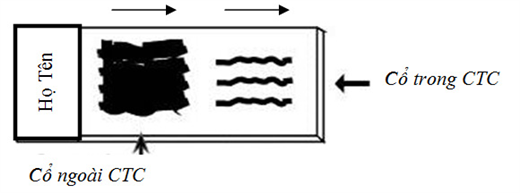
- Vị trí lấy mẫu: cổ trong cổ tử cung, cổ ngoài cổ tử cung, mỏm cắt âm đạo, âm đạo
- Họ và tên người lấy mẫu
- Thông tin lâm sàng: ngày kinh chót, chẩn đoán, điều trị trước đó.
- Dùng viết chì viết lên phần kính mờ của lam họ và tên bệnh nhân, mã số bệnh nhân. Nếu dùng 2 lam cho phết cổ tử cung, cần có ký hiệu rõ lam cho cổ ngoài cổ tử cung (C: ectocervix) và lam cho cổ trong cổ tử cung (E: endocervix). Cần lưu ý rằng phòng Tế bào sẽ không nhận mẫu nếu lam không có tên bệnh nhân.
- Lọ đựng lam cũng phải được ghi họ tên bệnh nhân rõ ràng.
4. Các dụng cụ cần thiết:
- Mỏ vịt âm đạo.
- Spatula bằng nhựa hoặc gỗ.
- Bàn chải tế bào (Cytobrush®).
- Lam sạch (có phần kính mờ ở một đầu lam).
- Viết chì đen (loại dành cho phòng xét nghiệm).
- Phiếu xét nghiệm tế bào.
II. CÁC BƯỚC LẤY MẪU
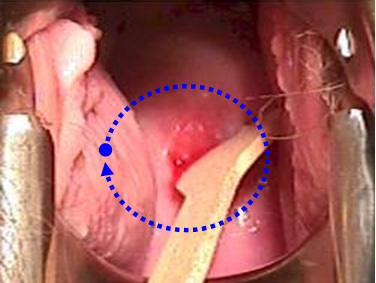
Trước khi lấy mẫu, viết lên lam họ và tên bệnh nhân và vị trí lấy bệnh phẩm. Dùng mỏ vịt không bôi trơn (có thể dùng nước muối sinh lý hoặc nước ấm để làm trơn mỏ vịt). Quan sát cổ tử cung, chú ý vùng chuyển tiếp (transformation zone) và các vùng bất thường ở cổ tử cung. Khi lấy mẫu, phải lấy được mẫu ở vùng chuyển tiếp và các vùng bất thường (nếu thấy được). Vùng chuyển tiếp là vùng nằm giữa 2 giới hạn (squamocolumnar junction): giới hạn ngoài (original squamocolumnar junction) là ở cổ ngoài cổ tử cung, nơi có các cửa tuyến (gland openings) và nang Naboth, giới hạn trong (active squamocolumnar junction) là nơi biểu mô trụ gặp biểu mô lát.
- Bước 1: Chùi sạch cổ tử cung (chỉ thực hiện khi có quá nhiều dịch tiết ở cổ tử cung): Dùng 1 que quấn gòn chùi nhẹ nhàng cổ tử cung, chùi bớt chất nhầy ở lỗ cổ tử cung. Lưu ý không được rửa cổ tử cung bằng nước muối sinh lý.
- Bước 2: Lấy mẫu
* Nếu cần xét nghiệm Chlamydia, thì lấy mẫu xét nghiệm Chlamydia trước khi làm phết cổ tử cung.
- Phết cổ tử cung thường quy:
Kỹ thuật lấy mẫu 1 lam (dùng 1 spatula và 1 bàn chải tế bào (Cytobrush®)):
- Nhanh chóng phết tế bào trên bàn chải lên một nửa lam, phía đối diện với phần kính mờ. Phết tế bào bằng cách xoay vòng bàn chải theo chiều dài của lam, vừa xoay vừa đè nhẹ bàn chải. Sau đó phết lớp thứ hai chồng lên phết thứ nhất.
- Cố định mẫu ngay lập tức.
- Cố định mẫu ngay lập tức.
Kỹ thuật lấy mẫu 2 lam (dùng 1 spatula và 1 bàn chải tế bào (Cytobrush®)):
- Đưa bàn chải tế bào vào trong cổ trong cổ tử cung và xoay nửa vòng. Rút bàn chải tế bào ra, nhanh chóng phết tế bào lên lam (2) (lam có ký hiệu “E”). Cố định mẫu ngay lập tức.
Kỹ thuật lấy mẫu 2 lam (kỹ thuật đang được áp dụng tại BV Từ Dũ – 2007) (dùng 1 spatula):
- Nhanh chóng phết tế bào trên đầu ngắn spatula lên lam (1) (lam có ký hiệu “C”). Phết theo 1 chiều duy nhất. Phết mỏng đều, sao cho chỉ có 1 lớp tế bào. Cố định mẫu ngay lập tức.
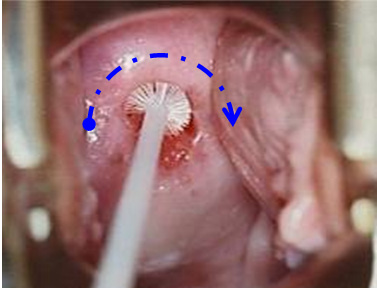
- Dùng đầu dài của spatula cào toàn bộ chu vi cổ trong cổ tử cung (xoay spatula 360o). Bắt đầu cào ở vị trí 9g, xoay 1 vòng theo chiều kim đồng hồ, kết thúc ở vị trí 9g.
- Nhanh chóng phết tế bào trên đầu dài của spatula lên lam (2) (lam có ký hiệu “E”). Phết theo 1 chiều duy nhất. Phết mỏng đều, sao cho chỉ có 1 lớp tế bào. Cố định mẫu ngay lập tức.
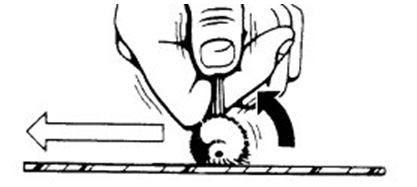
Dùng cây chổi tế bào đưa vào cổ tử cung, với phần lông dài ở giữa nằm ở trong kênh cổ tử cung, phần lông ngắn ở ngoài tựa vào cổ ngoài cổ tử cung. Xoay chổi 2-3 lần quanh bề mặt cổ tử cung, theo cả 2 chiều. Rút cây chổi ra. Phết tế bào lên lam giống như động tác quét sơn. Phết cả 2 mặt của chổi. Phết lớp thứ 2 phủ lên lớp thứ nhất.
- Phết âm đạo thường quy (4 lam):
Có thể làm phết âm đạo thường quy đồng thời cùng với làm phết cổ tử cung ở bệnh nhân có tử cung, hoặc có thể chỉ làm phết âm đạo ở bệnh nhân đã cắt tử cung. Lấy mẫu ở thành bên âm đạo hoặc lấy mẫu ở vùng nghi ngờ.
Dụng cụ: mỏ vịt âm đạo, 4 spatula bằng plastic hoặc bằng gỗ (nếu làm phết cổ tử cung thì thêm 1 spatula và 1 bàn chải tế bào), dung dịch cố định (ethyl alcohol 95% hoặc bình xịt dung dịch cố định), 4 lam (có phần kính mờ) (nếu làm phết cổ tử cung thì thêm 1-2 lam), viết chì, phiếu xét nghiệm.
Kỹ thuật:
- Lưu ý cần phải ghi rõ vị trí lấy mẫu lên lam, trước khi lấy mẫu.- Dùng mỏ vịt không bôi trơn (có thể dùng nước muối sinh lý hoặc nước ấm).
- Cố định mẫu ngay lập tức.
- Phết cổ tử cung nhúng dịch (ThinPrep® Pap test):
Dùng spatula và bàn chải tế bào:
- Lấy mẫu cổ trong cổ tử cung bằng bàn chải tế bào như trên mô tả. Nhúng bàn chải vào lọ Preserv Cyt®. Vừa xoay, vừa đè bàn chải vào thành lọ, làm 10 lần. Sau đó xoắn mạnh bàn chải để làm tế bào bong ra thêm. Lấy bàn chải ra. Đậy nắp lọ cẩn thận.
Đưa chổi vào cổ tử cung, với phần lông dài ở giữa nằm ở trong kênh cổ tử cung. Xoay chổi 2-3 lần quanh bề mặt cổ tử cung. Rút cây chổi ra, nhúng vào lọ đựng dung dịch cố định tế bào (Preserv Cyt®). Đập chổi vào đáy lọ 10 lần, đè mạnh để các sợi lông chổi rời nhau ra. Cuối cùng xoắn chổi thật mạnh để tế bào bong ra thêm. Lấy cây chổi ra. Đậy nắp lọ cẩn thận. Nhớ ghi tên bệnh nhân lên lọ.
- Để lam trong lọ có ethyl alcohol 95%. Phải bảo đảm phần bệnh phẩm trên lam nằm hoàn toàn trong dung dịch cố định.
- Hoặc xịt dung dịch cố định lên lam. Cầm bình xịt cách lam 20-30 cm.
- Gửi mẫu đến phòng Tế bào cùng với phiếu xét nghiệm tế bào.
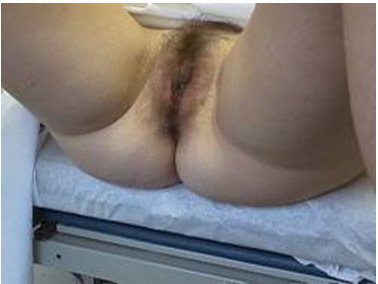 Tư thế bệnh nhân |  Làm trơn mỏ vịt bằng nước ấm | |
 Đặt nhẹ nhàng mỏ vịt | 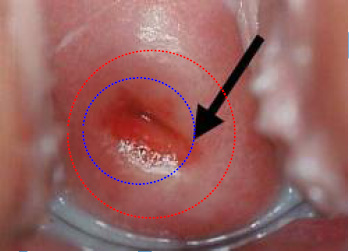 Lấy mẫu vùng chuyển tiếp | |
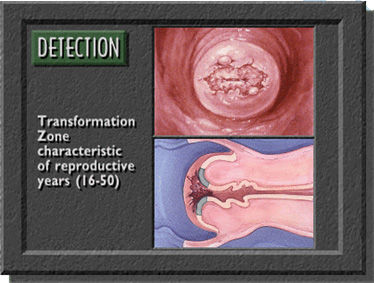 Vùng chuyển tiếp ở tuổi sanh đẻ | 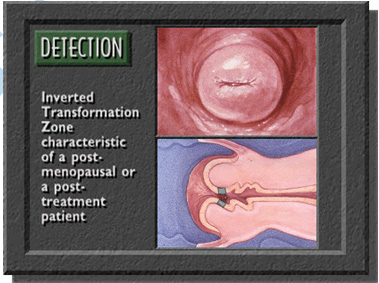 | |
 |  | |
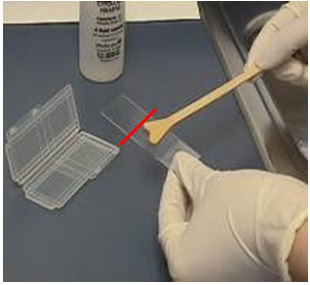 |  Xoay bàn chải theo chiều dọc lam | |
 | ||
 |  | |
  | ||
 | 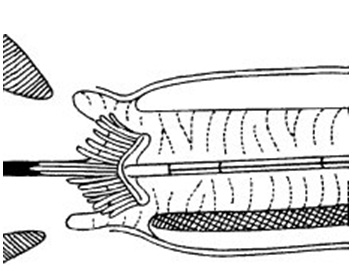 phần lông ngắn ở cổ
ngoài | |
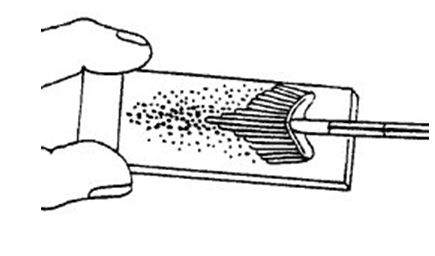 |  lọ đựng dung dịch cố định | |
Tài liệu tham khảo
- Amies, Conventional Pap Smear, Obstet Gynecol, 2002, 100:889-92
- Cytopathology Unit, Cytology Specimen Collection Guide, University of Rochester Medical Center, 2007, 1-17.
- E.J.Mayeaux, Optimizing the Papanicolaou Smear, 2005, http://www.sh.lsuhsc.edu/fammed/OutpatientManual/PapSmear.htm
- Kristie Whitehead, Conventional Pap Smear, Innovative pathology services, 2007,1-4.
- Kurman, Pap test collection procedure, JAMA, 1994, 271(23):1866-9.
- Robert Rome, Making the Pap Smear Better, Australian Government Publishing Service, 1993, 1-62.



