Ds. Huỳnh Kim Hằng
Khoa Dược - BVTừ Dũ
Thử nghiệm lâm sàng với một thuốc trước khi đưa ra thị trường chỉ được tiến hành trên một số lượng bệnh nhân rất ít so với lượng bệnh nhân sẽ sử dụng thuốc đó trong thực tế.
Mặt khác các thử nghiệm lâm sàng thường không đánh giá trên các đối tượng bệnh nhân đặc biệt như người già, trẻ em, phụ nữ có thai, bệnh nhân suy gan, suy thận…Điều đó cho thấy những thông tin về độ an toàn của một thuốc thu được từ các thử nghiệm lâm sàng là rất hạn chế, đặc biệt là thông tin về các phản ứng nghiêm trọng nhưng tần suất xảy ra thấp.
Do vậy, thông tin do các cán bộ y tế cung cấp về các phản ứng có hại của thuốc sẽ vô cùng hữu ích để tiếp tục đánh giá một cách toàn diện hơn về các nguy cơ tiềm ẩn của thuốc khi lưu hành trên thị trường.

Thảm họa Thaladomide
Một số thuốc bị rút khỏi thị trường thế giới
1. Thaladomide
Thuốc Thalidomide là loại thuốc chữa chứng ốm nghén cho những bà mẹ đang trong thời kỳ mang thai, được sử dụng rộng rãi trong những năm 1950 và 1960. Tuy nhiên, Thalidomide lại khiến cho các em bé ra đời trong tình trạng bị khuyết tật và không hoàn chỉnh. Những em bé này thường có tay hoặc chân ngắn hơn bình thường, mắc các chứng bệnh liên quan đến bệnh tim mạch, điếc bẩm sinh hoặc bị mù lòa hay các vấn đề về não bộ.
Năm 1957, Thalidomide được bán rộng rãi tại các nhà thuốc trên khắp thế giới và là loại thuốc chỉ bán theo chỉ định của bác sĩ. Theo báo cáo của nhóm Thalidomide Trust, hơn 10.000 trẻ nhỏ trên khắp thế giới bị mắc dị tật do thuốc Thalidomide. Khoảng 7.500 trẻ đã chết ngay khi chào đời hoặc khi còn nhỏ, còn trong số 5000 đến 6000 nạn nhân sống sót, có khoảng 400 người sống hiện đang sống ở Anh. Tuy nhiên, khi phát hiện ra thuốc Thalidomide có liên quan đến dị tật của hàng nghìn trẻ nhỏ, thuốc đã bị cấm sản xuất và lưu hành vào cuối năm 1961.
 |
 |
 |
2. Phenylbutazone (là NSAID nhóm Enolic acid, bị giới hạn sử dụng cuối năm 1983.
ADR điển hình: Thiếu máu bất sản, mất bạch cầu hạt.
Có 50% case tử vong tại Thụy Điển và Anh; 20% hoại tử tế bào gan, nhiễm độc gan nhẹ, tắc mật; dùng tọa dược có thể viêm trực tràng xuất huyết, thủng trực tràng & viêm đại tràng hoại tử.)
3. Cerivastatin (nhóm Statin hạ lipid huyết bằng cách ức chế HMG-CoA reductase, giảm LDL & tăng HDL: hạ cholesterol hiệu lực nhất, tác dụng ở liều thấp gấp từ 50-100 lần so với các thuốc khác.
ADR nguy hiểm làm tiêu cơ vân .
8/8/2001 Công ty Bayer tự nguyện rút sản phẩm Cerivastatin khỏi thị trường sau 30 ca tử vong.
4. Phenylpropanolamine: cấu trúc khác Pseudoephedrin có hoạt tính giao cảm tác động trực tiếp trên thụ thể α & β-adrenergic: gây chóng mặt, kích thích, rối loạn tâm thần, nhịp tim, tăng HA, đột quỵ, đặc biệt ở phụ nữ.
Từ 1998 nhiều nước trên thế giới ngưng lưu hành sản phẩm chứa PPA. Năm 2003 Cục QLD VN ngưng cấp SĐK cho sản phẩm PPA)
 |
 |
 |
5. Levamizol: Trị giun đũa, móc. Vì có tính ức chế miễn dịch nên dùng phối hợp với Floroquinolone để điều trị sau phẫu thuật ung thư tuyến of đại tràng. Thử nghiệm điều trị phong kết hợp với Dapson.
ADR: Mất bạch cầu hạt & giảm tiểu cầu; Da phát ban, ngứa, viêm mạch hoại tử; Nội tiết: hội chứng bất hợp hormon kháng lợi niệu ở bệnh nhân điều trị đồng thời với quinolon. Tác dụng phụ trên hệ TK, tiêu hóa và cơ xương.
6. Glafenine:
Tổ chức Y tế thế giới (WHO) cấm lưu hành và sử dụng.. Từ tháng 1/1992, nhiều nước trên thế giới đã xem xét sự không an toàn của các loại thuốc giảm đau có chứa Glafenine bởi chất này gây ra "sốc" nặng ở các bệnh nhân mẫn cảm của thuốc như viêm gan miễn dịch dị ứng, suy ống thận, rối loạn xuất huyết, tăng huyết áp, chức năng tim, hen suyễn, mang thai và cho con bú.... và đã cấm lưu hành.
7. Sulfasalazine: là sulfonamid kháng khuẩn, trị ký sinh trùng và chống nhiễm khuẩn dùng điều trị viêm loét đại tràng, bệnh Corhn thể hoạt động, viêm khớp đang thấp ở người bệnh không đáp ứng với NSAID.
Tác dụng phụ nguy hiểm: mất & giảm bạch cầu, thiếu máu, tan máu, chứng đại hồng cầu, ù tai, trầm cảm, phù mạch, bệnh huyết thanh, giảm toàn thể huyết cầu, giảm tiểu cầu, thiếu máu nguyên đại hồng cầu, viêm tụy, lupus ban đỏ toàn thân, hoại tử biểu bì (hội chứng Lyell), hội chứng Stevens-johnson, viêm da tróc vảy, nhạy cảm ánh sáng, viêm gan, viêm phế nang sơ hóa, hội chứng thận hư, protein niệu, tinh thể niệu, thay đổi nhận thức về mùi vị.
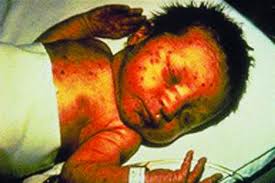
8. Gefitinib: Thuốc giảm đau (Non-Opioid) & thuốc hạ sốt
Như gefitinib là một tác nhân hóa trị liệu chọn lọc, dung nạp của nó là tốt hơn trước các tác nhân gây độc tế bào. Dùng điều trị ung thư phổi và vú. Phản ứng có hại của thuốc (ADRs) là chấp nhận được cho một căn bệnh có thể gây tử vong.
Các tác dụng phổ biến bất lợi: (ADR)
Rối loạn hệ tiêu hóa (tiêu chảy trầm trọng hoặc dai dẳng),
Rối loạn chuyển hóa và dinh dưỡng,
Rối loạn da và cấu trúc da (Mụn trứng cá rất phổ biến, viêm miệng)
Rối loạn toàn thân và tại chỗ dùng,
Rối loạn mạch máu, Rối loạn gan mật, Rối loạn thận và đường niệu,
Rối loạn hệ hô hấp, lồng ngực và trung thất: Bệnh phổi mô kẽ (1,1%) thường nghiêm trọng (CTC độ 3-4). Đã có báo cáo về các hậu quả nguy hiểm đến tính mạng (tử vong). Rối loạn mắt: Viêm xước giác mạc (0,3%), có thể hồi phục và đôi khi kèm với lông mi mọc lạc chỗ. xói mòn giác mạc viêm kết mạc, viêm bờ mi lông mi khác thường và sự phát triển của tóc
Hơn 800 người đã chết do tác dụng phụ của Iressa (hoạt chất chính là Gefitinib/ AstraZeneca), theo Bộ Y tế, Lao động và Phúc lợi. [Kyodo tin tức Jan 2011(8)]
 |
 |
9. Alosetron: Alosetron (thương hiệu ban đầu: Lotronex; bởi: GSK) Là chất đối kháng mạnh và chọn lọc đối các thụ thể serotonin 5-HT3. Thụ thể 5-HT3 hiện diện rất nhiều trên tế bào thần kinh ở đường ruột và sự kích thích quá mẫn là nguyên nhân gây ra vận động quá mức của ruột.
Alosetron chặn những thụ thể này, do đó có hiệu quả trong kiểm soát các triệu chứng ruột kích thích. Thuốc chỉ được chấp thuận để điều trị cho những phụ nữ bị HCRKT có tiêu chảy mạn tính nghiêm trọng, không đáp ứng với điều trị thông thường. Không dùng thuốc ở nam giới và trẻ em.
Thuốc hiện đang bán trên thị trường bởi Prometheus Laboratories Inc (San Diego), cũng theo Lotronex tên thương mại.
Alosetron đã bị rút khỏi thị trường vào năm 2000 do xảy ra nghiêm trọng đe dọa tính mạng các hiệu ứng bất lợi tiêu hóa, nhưng được giới thiệu lại vào năm 2002 và sử dụng hạn chế.
10. Trimetazidin:
Được cấp phép đầu tiên ở châu Âu năm 1978, dạng viên nén 20mg, viên nén giải phóng kéo dài 35mg và dung dịch uống 20mg/ml, với chỉ định:
- Điều trị dự phòng cơn đau thắt ngực
- Điều trị triệu chứng chóng mặt ù tai
- Điều trị giảm thị lực và rối loạn thị lực do nguyên nhân mạch máu
Từ năm 1998 – 2003 có 8 báo cáo tại Tây Ban Nha với bệnh nhân bị parkinson có ADR trên thần kinh: run, rối loạn vận động và rối loạn tư thế đi. Sau đó khảo sát Quốc gia về Cảnh giác Dược đã đánh giá lại độ an toàn của Trimetazidin tại Pháp. Phân tích dữ liệu an toàn từ 13/2/2008 đến 03/01/2011 có: 86 ADR trong cơ sở dữ liệu Cảnh giác Dược Quốc gia và 111 ADR từ MAH (Đơn vị được cấp phép lưu hành thuốc), 48 ca ADR về thần kinh (45 ca tại Pháp).
Trong thời gian theo dõi có 1019 ca ADR được báo cáo với 1916 biến cố gồm 475 ca nghiêm trọng và 544 không nghiêm trọng. Kể từ khi Trimetazidin được cấp phép lưu hành có 161 ca mắc hội chứng Parkinson và các triệu chứng khác cho đến 29/05/2011, với tỉ lệ mắc 0,36/100.000 bệnh nhân/năm. Trong số đó có 67 ca (88 biến cố) là nghiêm trọng, tương đương 0,15/100000 bệnh nhân/năm.
Đánh giá Ủy ban Cảnh giác Dược Quốc gia, Ủy ban tư vấn Quốc gia: Nguy cơ của Trimetazidin lớn hơn lợi ích. Và thông báo tới cơ quan quản lý Dược châu Âu đưa ra khuyến cáo về việc cân bằng giữa nguy cơ và lợi ích như sau:
- Sự cân bằng lơi ích – nguy cơ của Trimetazidintrong hỗ trợ điều trị cơn đau thắt ngực ở bệnh nhân không được kiểm soát tốt hoặc không dung nạp các phác đồ chống đau thắt ngực bậc 1, vẫn có tính tích cực giúp đưa ra các hạn chế nhưng cần được cảnh báo, thay đổi nhãn thuốc, tăng cường thêm hoạt động Cảnh giác Dược và các biện pháp giảm thiểu nguy cơ
- Đối với điều trị chứng ù tai, chóng mặt và rối loạn thị giác thì lợi ích nhỏ hơn rủi ro nên những chỉ định này không được phê duyệt.
Tài liệu tham khảo
1. Training Pharmacovigilance Skill For Healthcare Professionals
2. ANSM, Organisation de la pharmacovigilance national. http://ansm.sante.fr/Activites/ pharmacovigilance/Organisation-de-la- pharmacovigilance-nationale/%28offset%29/0
3. Committee fo Medicinal Products for Human use (CHMP). Guideline on conduct of pharmacovigilance for Medicines Use by the Paediatric Population for the studies conducted in children.25 jennuary2007
www.ema.europa.eu/docs/en GB/document library/Scienticific Guideline/2009/09/WC500003764.pdf
4. EMA, HMA. Guidelineon good pharmacovigilance practices (GVP) – Module VIII-Post-authorisation safety studies. 9 july 2012.
www.ema.europa.eu/docs/en GB/document library/Scienticific Guideline/2012/06/WC500129137.pdf
5. EncePP checklist for study Protocols
www. Encepp.eu/standards and guidances/index.html
6. Afssaps: Trimetazidine. Commission national de pharmacovigilance, 29 mars 2011. www.ansm.sante.fr/
7. EMA. Trimetazidine. The conclusion of Angency’s Committee for Medicinal Products for Human Use
(CHMP)http://www.ema.europa.eu/ema/index.iso?curl=pages/medicines/human/referrals/Trimetazidine/human referrals 000315.isp&mid=WC0b01ac05805c516f
8. Prescrise International. Trimetazidine. http://english.prescrise.org/en/Search.aspx



