05/04/2016
Trong năm 2015, bên cạnh việc tiếp tục thực hiện Quyết định 1088/QĐ-BYT ngày 04/04/2013 về việc ban hành hướng dẫn hoạt động giám sát phản ứng có hại của thuốc (ADR) tại các cơ sở khám, chữa bệnh và một số văn bản quản lý và hướng dẫn chuyên môn trong các chương trình y tế quốc gia, Bộ Y tế đã ban hành “Hướng dẫn Quốc gia về Cảnh giác Dược” kèm theo Quyết định số 2111/QĐ-BYT ngày 01/06/2015, hướng dẫn chi tiết về hoạt động giám sát phản ứng có hại và các vấn đề bất lợi khác liên quan đến thuốc tại Việt Nam.
1. Thông tin chung về báo cáo
Từ ngày 16/12/2014 đến hết ngày 15/12/2015, tổng số báo cáo ADR Trung tâm DI & ADR Quốc gia đã tiếp nhận và xử lý là 9266 báo cáo (đạt 102,1 báo cáo/1 triệu dân). Trong đó, 8566 báo cáo được gửi từ các cơ sở khám, chữa bệnh và 723 báo cáo ADR nghiêm trọng xảy ra trên lãnh thổ Việt Nam từ các đơn vị sản xuất, kinh doanh dược phẩm (23 báo cáo trùng với báo cáo từ các cơ sở khám, chữa bệnh).
Tổng số lượng báo cáo ADR nghiêm trọng là 3386 (chiếm 36,5% tổng số báo cáo ghi nhận được trong năm 2015).
Số lượng báo cáo nhận được từ năm 2003 - 2015 được trình bày trong Hình 1.
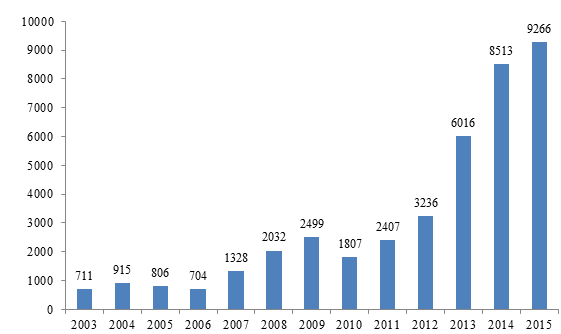 Hình 1: Số lượng báo cáo ADR từ năm 2003 đến năm 2015
Hình 1: Số lượng báo cáo ADR từ năm 2003 đến năm 2015
Tổng số báo cáo ADR nhận được trong năm 2015 từ các cơ sở khám, chữa bệnh thuộc các tỉnh/thành phố trong cả nước là 8566 báo cáo. So với số lượng báo cáo ADR năm 2014 (7787 báo cáo), số lượng báo cáo ADR đã tăng 10%.
Báo cáo từ các cơ sở khám, chữa bệnh ở vùng Đông Nam bộ chiếm tỷ lệ lớn nhất (27,7%), tiếp đến là đồng bằng sông Hồng (21,8%). Tây Bắc bộ là vùng có tỷ lệ báo cáo thấp nhất (3,7%).
Cơ sở y tế tuyến tỉnh tham gia báo cáo ADR với tỷ lệ cao nhất (52,9%), vượt xa các bệnh viện thuộc tuyến huyện (26,1%) và tuyến trung ương (12,3%). Các đơn vị ngoài công lập (các bệnh viện tư, các phòng khám tư,…) cũng đã tham gia báo cáo, tuy nhiên số lượng còn hạn chế (4,5%). Tỷ lệ báo cáo từ bệnh viện đại học là 2,2% và từ bệnh viện ngành là 1,9%.
Báo cáo chủ yếu tập trung từ các bệnh viện đa khoa với tỷ lệ là 64,6%.
1.1. Về tình hình gửi báo cáo của các đơn vị y tế ở các tỉnh/ thành phố
+ Tất cả 63 tỉnh, thành phố đã tham gia gửi báo cáo ADR trong năm 2015.
+ Các tỉnh, thành phố gửi nhiều báo cáo nhất được thống kê trong bảng 1. Trong đó, hai thành phố lớn Hà Nội và TP. Hồ Chí Minh có tỷ lệ báo cáo cao nhất. TP. Đà Nẵng, tỉnh Quảng Ninh và TP. Hồ Chí Minh là các địa phương có công tác báo cáo ADR hiệu quả nhất với số báo cáo/1 triệu dân tương ứng 444,6 báo cáo/1 triệu dân, 342,7 báo cáo/1 triệu dân và 239,2 báo cáo/1 triệu dân, tỷ lệ này đã cao hơn tiêu chuẩn của một hệ thống Cảnh giác Dược hoạt động có hiệu quả của Tổ chức Y tế thế giới (200 báo cáo/1 triệu dân). Ngoài 3 tỉnh/thành phố này, còn có tỉnh Điện Biên và Khánh Hòa cũng có số báo cáo trên 1 triệu dân lớn hơn 200 báo cáo/1 triệu dân, với số liệu tương ứng là 206,3 và 203,9 báo cáo/1 triệu dân.
Bảng 1: Danh sách 10 tỉnh/thành phố gửi báo cáo ADR nhiều nhất
|
STT |
Tỉnh/Thành phố |
Số báo cáo |
Tỷ lệ (%) |
Số báo cáo/1 triệu dân |
|
1 |
TP. Hồ Chí Minh |
1909 |
22,3% |
239,2 |
|
2 |
Hà Nội |
1220 |
14,2% |
171,9 |
|
3 |
Đà Nẵng |
448 |
5,2% |
444,6 |
|
4 |
Quảng Ninh |
411 |
4,8% |
342,7 |
|
5 |
Thanh Hóa |
291 |
3,4% |
83,2 |
|
6 |
An Giang |
254 |
3,0% |
117,8 |
|
7 |
Khánh Hòa |
244 |
2,8% |
203,9 |
|
8 |
Cần Thơ |
238 |
2,8% |
192,2 |
|
9 |
Hải Phòng |
235 |
2,7% |
120,8 |
|
10 |
Nghệ An |
196 |
2,3% |
64,5 |
+ Tổng số có 728 cơ sở khám, chữa bệnh đã gửi báo cáo ADR (tăng 5,4% so với năm 2014), danh sách các đơn vị gửi nhiều báo cáo nhất được liệt kê trong bảng 2.
Với việc triển khai tích cực công tác theo dõi phản ứng có hại của thuốc, bệnh viện Phạm Ngọc Thạch và bệnh viện Bạch Mai đã đóng góp số lượng lớn báo cáo ADR vào cơ sở dữ liệu phản ứng có hại của thuốc trong năm 2015 (4,8% và 3,0%). Có 3 bệnh viện mới vào danh sách các bệnh viện gửi nhiều báo cáo nhất trong năm 2015 bao gồm bệnh viện Đại học Y Dược TP. Hồ Chí Minh, bệnh viện Phụ Sản - Nhi Đà Nẵng và bệnh viện Thanh Nhàn. Các bệnh viện gửi nhiều báo cáo chủ yếu tập trung ở Thành phố Hồ Chí Minh. Cả nước đã có 728 đơn vị tham gia gửi báo cáo ADR trong năm 2015, bên cạnh đó, còn rất nhiều cơ sở khám, chữa bệnh chưa tham gia thực hiện gửi báo cáo ADR.
Bảng 2: Danh sách 10 cơ sở khám chữa bệnh gửi báo cáo nhiều nhất
|
STT |
Tên bệnh viện |
Tỉnh/ Thành phố |
Số BC theo BV |
Tỷ lệ (%) |
|
1 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
411 |
4,8% |
|
2 |
Bệnh viện Bạch Mai |
Hà Nội |
256 |
3,0% |
|
3 |
Bệnh viện Đại học Y Dược TP. HCM |
TP. Hồ Chí Minh |
172 |
2,0% |
|
4 |
Bệnh viện Đa khoa Đà Nẵng |
Đà Nẵng |
155 |
1,8% |
|
5 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
152 |
1,8% |
|
6 |
Bệnh viện Phụ Sản - Nhi Đà Nẵng |
Đà Nẵng |
141 |
1,6% |
|
7 |
Bệnh viện Thanh Nhàn |
Hà Nội |
138 |
1,6% |
|
8 |
Bệnh viện Đa khoa tỉnh Quảng Ninh |
Quảng Ninh |
126 |
1,5% |
|
9 |
Bệnh viện Việt Nam - Thụy Điển Uông Bí |
Quảng Ninh |
125 |
1,5% |
|
10 |
Bệnh viện Hùng Vương |
TP. Hồ Chí Minh |
123 |
1,4% |
1.2. Về chất lượng báo cáo
Đa số báo cáo gửi về ghi đầy đủ các thông tin yêu cầu gồm 4 trường thông tin bắt buộc bao gồm: thông tin người bệnh, thông tin về phản ứng có hại, thông tin về thuốc nghi ngờ và thông tin về người báo cáo. Tuy nhiên, vẫn còn một số báo cáo thông tin chưa rõ ràng, còn viết tắt và viết khó đọc gây khó khăn trong quá trình xử lý và thẩm định. Một số thông tin thiếu, một số thông tin có nhưng sơ sài gây khó khăn cho thẩm định báo cáo: diễn biến ADR (sau khi ngừng thuốc, tái sử dụng thuốc (nếu có), lý do dùng thuốc, liều dùng, …
1.3. Thông tin về người báo cáo
Bảng 3: Thông tin về đối tượng gửi báo cáo
|
Đối tượng gửi báo cáo |
Số lượng |
Tỷ lệ (%) n=8566 |
|
Dược sĩ |
3163 |
36,9% |
|
Bác sĩ – Y sĩ |
2893 |
33,8% |
|
Điều dưỡng - Nữ hộ sinh |
1711 |
20,0% |
|
Khác |
117 |
1,4% |
|
Không có thông tin |
682 |
8,0% |
|
Tổng |
8566 |
100,0% |
Khác với các năm trước, năm 2015 có sự dịch chuyển về đối tượng báo cáo. Trong đó, đối tượng gửi báo cáo nhiều nhất là dược sĩ, chiếm 36,9%, tiếp đến là bác sĩ – y sĩ (33,8%), điều dưỡng và nữ hộ sinh (20,0%). Như vậy, vai trò của dược sĩ trong công tác báo cáo ADR đã được chú trọng hơn.
1.4. Thông tin về bệnh nhân trong các báo cáo ADR
Trong số 8566 báo cáo có 47 báo cáo liên quan đến chất lượng thuốc, trong đó thuốc chưa sử dụng trên bệnh nhân hoặc thông tin bệnh nhân không thu thập được. Vì vậy, thông tin bệnh nhân được thống kê trên 8519 báo cáo.
Thông tin về phân bố tuổi và giới tính bệnh nhân được thể hiện trong bảng 4.
Bảng 4: Phân bố tuổi của bệnh nhân trong báo cáo
|
Phân bố |
Số lượng |
Tỷ lệ (%) (n=8517) |
|
Tuổi |
||
|
≤ 1 tuổi |
451 |
5,3 |
|
>1 - 12 tuổi |
824 |
9,7 |
|
>12 - 18 tuổi |
328 |
3,9 |
|
>18 - 60 tuổi |
5169 |
60,7 |
|
>60 tuổi |
1616 |
19,0 |
|
Không có thông tin |
129 |
1,5 |
|
Phân bố |
Số lượng |
Tỷ lệ (%) (n=8517) |
|
Giới |
||
|
Nam |
3905 |
45,8 |
|
Nữ |
4478 |
52,6 |
|
Không có thông tin |
134 |
1,6 |
|
Tỷ lệ nam:nữ |
0,87 |
|
ADR thường được ghi nhận nhiều nhất ở nhóm đối tượng người trưởng thành từ 18-60 tuổi (chiếm 60,7%); tiếp theo là đối tượng người cao tuổi (> 60 tuổi) (19,0%); ADR ở trẻ em từ 1 đến 12 tuổi và trẻ dưới 1 tuổi cũng chiếm một tỷ lệ đáng lưu ý tương ứng là 9,7% và 5,3%. Nữ giới được ghi nhận có tỷ lệ gặp ADR (52,6%) cao hơn so với nam giới.
2. THÔNG TIN VỀ THUỐC NGHI NGỜ GÂY ADR
Trong 8566 báo cáo có 10 báo cáo về hóa chất, chỉ y tế …, do đó tổng số thuốc nghi ngờ được báo cáo được thống kê từ 8556 báo cáo ADR là 10368 thuốc (tỷ lệ 1,21 thuốc/1 báo cáo).
2.1. Tổng hợp phân loại báo cáo ADR theo đường dùng thuốc
Bảng 5: Tổng hợp báo cáo ADR theo đường dùng thuốc
|
STT |
Đường dùng |
Số lượng |
Tỷ lệ % (n=8556) |
|
1 |
Tiêm tĩnh mạch, truyền tĩnh mạch |
4176 |
48,8% |
|
2 |
Uống |
3480 |
40,7% |
|
3 |
Tiêm bắp |
902 |
10,5% |
|
4 |
Test da |
291 |
3,4% |
|
5 |
Thuốc đặt trực tràng |
278 |
3,2% |
|
6 |
Tiêm dưới da |
97 |
1,1% |
|
7 |
Khác |
421 |
4,9% |
|
8 |
Không có thông tin |
723 |
8,5% |
Phản ứng có hại xảy ra với hầu hết các đường dùng thuốc. Tuy nhiên, phản ứng có hại xảy ra khi dùng thuốc bằng đường tiêm truyền tĩnh mạch và đường uống chiếm tỷ lệ nhiều nhất tương ứng là 48,8% và 40,7%. Phản ứng có hại xảy ra khi dùng thuốc bằng đường tiêm bắp cũng chiếm tỷ lệ cao (10,5%).
2.2. Tổng hợp phân loại các nhóm thuốc nghi ngờ gây ADR theo nhóm dược lý
Bảng 6: Các nhóm thuốc nghi ngờ gây ADR
|
Mã phân loại ATC |
Nhóm thuốc |
Số lượng |
Tỷ lệ (%) n=8556 |
|
J |
Kháng khuẩn tác dụng toàn thân |
6,561 |
76,7% |
|
N |
Hệ thần kinh |
772 |
9,0% |
|
M |
Hệ cơ - xương |
686 |
8,0% |
|
P |
Thuốc kháng kí sinh trùng và côn trùng |
398 |
4,7% |
|
B |
Máu và cơ quan tạo máu |
426 |
5,0% |
|
A |
Đường tiêu hóa và chuyển hóa |
371 |
4,3% |
|
C |
Hệ tim mạch |
171 |
2,0% |
|
R |
Hệ hô hấp |
140 |
1,6% |
|
L |
Thuốc chống ung thư và điều hoà miễn dịch |
172 |
2,0% |
|
H |
Các chế phẩm hormon dùng đường toàn thân, trừ hormon sinh dục và insulin |
94 |
1,1% |
|
G |
Hệ sinh dục tiết niệu và các hormon sinh dục |
90 |
1,1% |
|
D |
Da liễu |
21 |
0,2% |
|
S |
Cơ quan cảm thụ |
20 |
0,2% |
|
V |
Các thuốc khác |
239 |
2,8% |
|
U |
Không rõ |
207 |
2,4% |
Nhóm thuốc kháng khuẩn dùng đường toàn thân là nhóm thuốc được báo cáo nhiều nhất (76,7%). Tiếp theo là nhóm thuốc tác dụng trên hệ thần kinh chiếm tỷ lệ là 9,0%, nhóm thuốc tác dụng trên hệ cơ xương chiếm tỷ lệ là 8,0%.
2.3. Nhóm dược lý được báo cáo nhiều nhất
Bảng 7: Các nhóm dược lý được báo cáo nhiều nhất
|
Mã phân loại ATC |
Nhóm thuốc |
Số lượng |
Tỷ lệ (%) n=8556 |
|
J01D |
Kháng sinh beta-lactam khác (bao gồm cephalosporin thế hệ từ 1 đến 4, carbapenem,…) |
2889 |
33,8% |
|
J04A |
Thuốc điều trị lao |
994 |
11,6% |
|
M01A |
Chống viêm, chống thấp khớp |
598 |
7,0% |
|
J01M |
Kháng sinh nhóm quinolon |
585 |
6,8% |
|
J01C |
Kháng sinh nhóm beta-lactam, họ penicilin |
564 |
6,6% |
|
J01G |
Kháng sinh nhóm aminoglycosid |
514 |
6,0% |
|
P01B |
Thuốc điều trị sốt rét |
395 |
4,6% |
|
J01X |
Kháng sinh nhóm khác (bao gồm kháng sinh nhóm glycopeptid, các polymyxin, dẫn chất 5 nitro-imidazol,…) |
279 |
3,3% |
|
N02B |
Thuốc giảm đau và hạ sốt khác |
274 |
3,2% |
|
J05A |
Thuốc kháng virus |
239 |
2,8% |
Các kháng sinh nhóm beta-lactam khác (cephalosporin thế hệ từ 1 đến 4, carbapenem…) là nhóm kháng sinh có tỷ lệ báo cáo biến cố có hại nhiều nhất (33,8%). Tiếp theo là nhóm thuốc điều trị lao (11,6%) và kháng sinh nhóm thuốc chống viêm, chống thấp khớp (7,0%).
2.4. Thuốc nghi ngờ được báo cáo nhiều nhất
Các thuốc nghi ngờ gây ADR được báo cáo nhiều nhất được trình bày trong bảng 8.
Bảng 8: Danh sách 10 thuốc nghi ngờ được báo cáo nhiều nhất
|
STT |
Tên thuốc |
Số lượng |
Tỷ lệ (%) (n=8556) |
|
1 |
cefotaxim |
963 |
11,3% |
|
2 |
ceftriaxon |
486 |
5,7% |
|
3 |
diclofenac |
451 |
5,3% |
|
4 |
ceftazidim |
412 |
4,8% |
|
5 |
streptomycin |
342 |
4,0% |
|
6 |
ciprofloxacin |
321 |
3,8% |
|
7 |
cefuroxim |
246 |
2,9% |
|
8 |
amoxicilin/acid clavulanic |
222 |
2,6% |
|
9 |
pyrazinamid |
217 |
2,5% |
|
10 |
paracetamol |
212 |
2,5% |
Các thuốc nghi ngờ gây phản ứng có hại xuất hiện nhiều nhất trong các báo cáo ADR thuộc 3 nhóm chính: nhóm thuốc kháng sinh nhiều nhất với 6 đại diện là cefotaxim, ceftriaxon, ceftazidim, ciprofloxacin, cefuroxim và amoxicilin/acid clavulanic; nhóm thuốc điều trị lao (streptomycin, pyrazinamid) và nhóm thuốc giảm đau, hạ sốt, chống viêm (diclofenac, paracetamol). Cefotaxim vẫn là thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất với tỷ lệ là 11,3%.
2.5. Thuốc điều trị HIV/AIDS
Tổng số báo cáo tự nguyện liên quan đến thuốc điều trị HIV/AIDS là 178 báo cáo (giảm nhiều so với năm 2014 là 460 báo cáo). Trong đó, phác đồ điều trị HIV/AIDS nghi ngờ gây ADR nhiều nhất là phác đồ zidovudin/lamivudin/nevirapin (viên kết hợp 3 thành phần) với tỷ lệ là 24,2%, tiếp đến là phác đồ tenofovir/lamivudin/efaviren (là phác đồ ưu tiên đang sử dụng chủ yếu trên người bệnh nhiễm HIV/AIDS) chiếm 23,6%. Thuốc nhiễm trùng cơ hội dùng kèm sulfamethoxazol/trimethoprim có 9 báo cáo ADR (chiếm 5,1%). (bảng 9)
Bảng 9: Danh sách thuốc điều trị HIV/AIDS được báo cáo
|
STT |
Tên thuốc |
Số lượng |
Tỷ lệ % (n=178) |
|
1 |
Zidovudin/lamivudin/nevirapin (viên kết hợp 3 thành phần) |
43 |
24,2% |
|
2 |
Tenofovir/lamivudin/efavirenz |
42 |
23,6% |
|
3 |
Efavirenz |
40 |
22,5% |
|
4 |
Zidovudin/lamivudin |
25 |
14,0% |
|
5 |
Tenofovir |
22 |
12,4% |
|
6 |
Lamivudin |
20 |
11,2% |
|
7 |
Nevirapin |
11 |
6,2% |
|
8 |
Zidovudin |
10 |
5,6% |
|
9 |
Cotrimoxaxol (sulfamethoxazol/trimethoprim) |
9 |
5,1% |
|
10 |
Lopinavir/ritonavir |
5 |
2,8% |
|
11 |
Zidovudin/lamivudin/efavirenz |
4 |
2,2% |
|
12 |
Tenoforvir/lamivudin/nevirapin |
3 |
1,7% |
|
13 |
Stavudin/lamivudin/efavirenz |
3 |
1,7% |
|
14 |
Tenofovir/zidovudin/lamivudin |
2 |
1,1% |
2.6. Thuốc điều trị lao
Trong tổng số 1057 báo cáo về phản ứng có hại liên quan tới thuốc điều trị lao, có nhiều báo cáo mà các thuốc nghi ngờ gây ADR thường được sử dụng phối hợp, nên tổng tần suất xuất hiện của thuốc điều trị lao là 1339. (bảng 10)
Bảng 10: Danh sách thuốc điều trị lao được báo cáo
|
STT |
Tên thuốc |
Số lượng |
Tỷ lệ % (n=1057) |
|
1 |
Streptomycin |
343 |
32,5% |
|
2 |
Pyrazinamid |
218 |
20,6% |
|
3 |
Rifampicin |
184 |
17,4% |
|
4 |
Rifampicin/isoniazid/pyrazinamid/ethambutol |
174 |
16,5% |
|
5 |
Ethambutol |
146 |
13,8% |
|
6 |
Rifampicin/isoniazid/pyrazinamid |
100 |
9,5% |
|
7 |
Isoniazid |
66 |
6,2% |
|
8 |
Rifampicin/isoniazid |
34 |
3,2% |
|
9 |
Kanamycin |
21 |
2,0% |
|
10 |
Prothionamid |
21 |
2,0% |
|
11 |
Levofloxacin |
14 |
1,3% |
|
12 |
Cycloserin |
10 |
0,9% |
|
13 |
Amikacin |
3 |
0,3% |
|
14 |
PAS |
2 |
0,2% |
|
15 |
Capreomycin |
2 |
0,2% |
|
16 |
Clofazimin |
1 |
0,1% |
Thuốc điều trị lao nghi ngờ gây ADR nhiều nhất là streptomycin với 32,5%, sau đó pỷrazinamid với 20,6%, rifampicin có tỷ lệ là 17,4%.
2.7. Thuốc điều trị sốt rét
Tổng số báo cáo liên quan đến thuốc điều trị sốt rét là 206 báo cáo. Các thuốc điều trị sốt rét nghi ngờ gây ADR được tổng hợp trong bảng 11.
Bảng 11: Danh sách thuốc điều trị sốt rét được báo cáo
|
STT |
Tên thuốc |
Số lượng |
Tỷ lệ % (n=206) |
|
1 |
Piperaquin phosphat-dihydroartemisinin/primaquin |
103 |
50,0% |
|
2 |
Chloroquin/primaquin |
89 |
43,2% |
|
3 |
Artequick (artemisinin/piperaquin) |
14 |
6,8% |
|
Tổng cộng |
206 |
100,0 |
|
Nhận xét: Phản ứng có hại chủ yếu xảy ra với thuốc phối hợp piperaquin phosphat-dihydroartemisinin và primaquin (chiếm 50%); kế đến là chloroquin và primaquin (chiếm 43,2%) và Artequick (artemisinin/piperaquin) chiếm 6,8%.
3. KẾT QUẢ THẨM ĐỊNH VÀ PHẢN HỒI BÁO CÁO ADR
Tổng số báo cáo đã được nhóm chuyên gia thẩm định và được Trung tâm DI&ADR Quốc gia phản hồi cho cán bộ y tế và đơn vị gửi báo cáo trong năm 2015 là 5100 báo cáo. Các báo cáo được ưu tiên phản hồi bao gồm báo cáo khẩn, báo cáo nghiêm trọng và báo cáo từ các chương trình y tế quốc gia (HIV, Lao, Sốt rét). Báo cáo nghiêm trọng được xác định là báo cáo có phản ứng có hại dẫn đến một trong những hậu quả sau: tử vong; đe dọa tính mạng; buộc người bệnh phải nhập viện để điều trị hoặc kéo dài thời gian nằm viện của người bệnh; để lại di chứng nặng nề hoặc vĩnh viễn cho người bệnh; gây dị tật bẩm sinh ở thai nhi; hoặc bất kỳ phản ứng có hại được cán bộ y tế nhận định là gây ra hậu quả nghiêm trọng về mặt lâm sàng.
3.1. Tổng hợp phân loại tổ chức cơ thể bị ảnh hưởng và các phản ứng có hại ghi nhận được qua các báo cáo ADR
- Rối loạn da và mô dưới da (ngứa, ban đỏ, bọng nức, phù, hội chứng Stevens- Johnson, hồng ban đa dạng, viêm da tróc vẩy, ban xuất huyết, loét da, hoại tử thượng bì, ...
- Rối loạn hệ cơ - xương - khớp ( đau, nhức xương khớp, yếu cơ, viêm khớp, viêm cơ delta)
- Rối loạn hệ thần kinh trung ương và ngoại biên (đau đầu, chóng mặt, run, tê lưỡi, tê chân tay, tê môi, miệng, co giật, co cứng cơ, bủn rủn tay chân, viêm thần kinh thị giác, ...)
- Rối loạn hệ thần kinh thực vật (đau nhức người)
- Rối loạn thị giác (mắt mờ, đỏ, chảy nước mắt, phù giác mạc, sung, đau mắt)
- Rối loạn thính giác và tiền đình (ù tai, giảm thính lực...)
- Rối loạn tâm thần (chán ăn, kích thích, mất ngủ, rối loạn tâm thần, ác mộng, trầm cảm, ảo giác, loạn hành vi, căng thẳng, hoang tưởng, rối loạn giấc ngủ)
- Rối loạn hệ tiêu hóa (buồn nôn, nôn, đau bụng, loét miệng, tiêu chảy, táo bón, xuất huyết tiêu hóa, khô môi miệng, ...)
- Rối loạn hệ gan mật (tăng men gan, vàng da, bất thường chức năng gan, viêm gan, ...)
- Rối loạn chuyển hóa và dinh dưỡng (rối loạn phân bố mỡ, tăng acid uric máu, hạ kali huyết, đường niệu, gout)
- Rối loạn nội tiết (vú to ở nam, tăng TSH)
- Rối loạn hệ tim mạch (mạch nhanh, châm, rối loạn nhịp tim, rung thất, ngưng tim, tím tái, tăng hoặc hạ huyết áp, suy tuần hoàn, mạch quay nhẹ)
- Rối loạn mạch ngoại vi (đỏ mặt, viêm tĩnh mạch tại chỗ, xuất huyết kết mạc, …)
- Rối loạn hệ hô hấp (khó thở, ho, đau họng, phổi ran rít, SpO2 giảm, co thắt phế quản, chảy máu mũi, xuất tiết đờm dãi…)
- Rối loạn hồng cầu máu, bạch cầu và hệ võng mô (thiếu máu, giảm bạch cầu, tăng IgE)
- Rối loạn hệ đông máu - chảy máu (sung huyết da, giảm tiểu cầu, xuất huyết)
- Rối loạn hệ tiết niệu (sưng, phù mặt, tăng creatinin, suy thận, protein niệu, ...)
- Rối loạn cơ quan sinh dục (viêm loét, sưng, phù nề, chảy dịch, quá kích buồng trứng...)
- Rối loạn toàn than (sốc phản vệ, mệt, sốt, lạnh run, khó chịu, đau chi, tăng tiết dịch,…)
- Phản ứng tại chỗ (mẩn đỏ, ngứa, đau rát, bầm tím viêm tại chỗ …)
Các tổ chức cơ thể bị ảnh hưởng nhiều bao gồm rối loạn da và mô dưới da, rối loạn toàn thân, hệ thần kinh trung ương và ngoại biên. Trong đó, các phản ứng có hại xảy ra với tỷ lệ cao là sốc phản vệ/phản ứng phản vệ (21,6%) và các phản ứng ngoài da (ngứa, ban đỏ, phát ban, dị ứng,...). Đây là các phản ứng dễ được cán bộ y tế phát hiện thông qua biểu hiện lâm sàng.
Ngược lại, những báo cáo ADR liên quan đến kết quả bất thường xét nghiệm chỉ chiếm tỷ lệ thấp như độc tính của thuốc trên gan: viêm gan (0,96%), tăng enzym gan (ASAT, ALAT) (2,36%), tăng bilirubin huyết thanh (0,62%); phản ứng có hại trên huyết học như thiếu máu (1,68%); rối loạn nội tiết, điện giải, độc tính trên thận của thuốc; những phản ứng có hại đòi hỏi phải có sự thăm khám lâm sàng ở trình độ chuyên môn sâu như phản ứng trên tim mạch, trên thần kinh trung ương, ảnh hưởng trên tâm thần,... ít được ghi nhận.
3.2. Cặp thuốc - phản ứng có hại được báo cáo nhiều nhất
10 cặp thuốc – ADR được báo cáo nhiều nhất được tổng hợp trong bảng 12.
Bảng 12: 10 cặp thuốc – ADR được ghi nhận nhiều nhất
|
STT |
Thuốc |
ADR |
Số lượng |
Tỷ lệ % (n=4705) |
|
1 |
cefotaxim |
Ban đỏ |
170 |
3,6% |
|
2 |
cefotaxim |
Sốc phản vệ/ phản ứng phản vệ |
156 |
3,3% |
|
3 |
cefotaxim |
Ngứa |
141 |
3,0% |
|
4 |
primaquin |
Đau đầu |
97 |
2,1% |
|
5 |
ceftriaxon |
Sốc phản vệ/ phản ứng phản vệ |
97 |
2,1% |
|
6 |
diclofenac |
Phù mắt |
95 |
2,0% |
|
7 |
primaquin |
Mệt mỏi |
89 |
1,9% |
|
8 |
cefotaxim |
Phát ban |
75 |
1,6% |
|
9 |
cefotaxim |
Dị ứng |
73 |
1,6% |
|
10 |
ceftriaxon |
Ban đỏ |
69 |
1,5% |
Các cặp thuốc – ADR được báo cáo nhiều chủ yếu liên quan đến 2 kháng sinh cefotaxim và ceftriaxon với đa số là phản ứng trên da. Cặp thuốc – ADR được báo cáo nhiều nhất là cefotaxim – ban đỏ (170 trường hợp). Bên cạnh đó, phản ứng sốc phản vệ và phản ứng phản vệ liên quan đến cefotaxim và ceftriaxon đều được ghi nhận với tỷ lệ 3,3% và 2,1%.
Sốc phản vệ/ phản ứng phản vệ là phản ứng có hại nghiêm trọng được ghi nhận nhiều nhất, với tổng số 1018 trường hợp. Các thuốc nghi ngờ gây sốc phản vệ nhiều nhất trong các báo cáo ADR gồm: kháng sinh (cefotaxim, ceftriaxon, ceftazidim, cefuroxim, cefalexin,…); thuốc giảm đau, hạ sốt, chống viêm (paracetamol, diclofenac) và thuốc cản quang có chứa iod (iobitridol, iopromid). Do đó, cần lưu ý thận trọng khi sử dụng các thuốc cho người bệnh có nguy cơ cao. Tại các phòng khám, buồng điều trị và nơi có dùng thuốc phải có sẵn một hộp thuốc chống sốc phản vệ (chi tiết xin xem thông tư số 08/1999-TT-BYT ngày 04/05/1999 của Bộ Y tế: Hướng dẫn phòng và cấp cứu sốc phản vệ).
Các phản ứng trên gan như tăng bilirubin máu, tăng men gan, viêm gan chủ yếu liên quan đến các thuốc điều trị lao. Phản ứng thiếu máu chủ yếu liên quan đến thuốc điều trị HIV/AIDS.
3.3. Diễn biến của ADR đã được ghi nhận
Bảng 13: Diễn biến của ADR đã được ghi nhận và phản hồi trong năm 2015
|
Diễn biến |
Số lượng |
Tỷ lệ (%) |
|
Hồi phục không có di chứng |
2786 |
54,6% |
|
Hồi phục có di chứng |
57 |
1,1% |
|
Tử vong không liên quan đến thuốc |
7 |
0,1% |
|
Tử vong do phản ứng có hại của thuốc |
42 |
0,8% |
|
Đang hồi phục |
951 |
18,6% |
|
Chưa hồi phục |
121 |
2,4% |
|
Không có thông tin |
1136 |
22,3% |
|
Tổng |
5100 |
100,0% |
Phần lớn các trường hợp được báo cáo là hồi phục không có di chứng, chiếm tỷ lệ 54,6%. ADR nghiêm trọng liên quan đến tử vong được báo cáo trên 49 bệnh nhân, chiếm 0,9%. Phản ứng có hại của thuốc để lại di chứng trên bệnh nhân chiếm tỷ lệ 1,1%. Ngoài ra, số báo cáo thiếu hoặc không có thông tin về diễn biến phản ứng sau xử trí ADR còn chiếm tỷ lệ cao (22,3%).
4. KẾT LUẬN
Trong năm 2015, Trung tâm DI & ADR Quốc gia và Trung tâm DI & ADR khu vực TP. Hồ Chí Minh đã tiếp nhận 9266 báo cáo ADR tương ứng với 102,1 báo cáo/1 triệu dân, tăng 8,8% so với số lượng báo cáo năm 2014 (8513 báo cáo ADR – tương ứng với 94,9 báo cáo/1 triệu dân). Tuy vậy, tỷ lệ số báo cáo/1 triệu dân vẫn còn thấp so với tiêu chuẩn hệ thống Cảnh giác Dược hoạt động có hiệu quả của Tổ chức Y tế thế giới (200 báo cáo/1 triệu dân). Thành phố Hồ Chí Minh và Hà Nội là hai thành phố có tỷ lệ báo cáo ADR cao nhất (tương ứng 22,3% và 14,2%). Năm tỉnh/ thành phố có số báo cáo/1 triệu dân cao hơn 200 báo cáo /1 triệu dân là TP. Đà Nẵng, tỉnh Quảng Ninh và TP. Hồ Chí Minh, tỉnh Điện Biên và tỉnh Khánh Hòa với số báo cáo/1 triệu dân tương ứng 444,6; 342,7; 239,2; 206,3 và 203,9 báo cáo/1 triệu dân. Phần lớn báo cáo được gửi từ các đơn vị ở vùng Đông Nam bộ và đồng bằng sông Hồng, từ các bệnh viện tuyến tỉnh, bệnh viện đa khoa và bệnh viện thuộc khối công lập.
Số báo cáo đã được Trung tâm DI & ADR Quốc gia thẩm định và phản hồi là 5100 báo cáo (chiếm 55,04% tổng số báo cáo ADR). Số báo cáo ADR nghiêm trọng là 3386 báo cáo (chiếm 36,5% tổng số báo cáo ADR), trong đó có 49 trường hợp nghiêm trọng dẫn đến hậu quả tử vong đã được xử lý khẩn. Nhóm kháng sinh betalactam khác (cefotaxim, ceftriaxon, ceftazidim, ciprofloxacin, cefuroxim và amoxicilin/acid clavulanic…), thuốc điều trị lao (streptomycin, pyrazinamid...) và thuốc giảm đau, hạ sốt, chống viêm (diclofenac, paracetamol) được báo cáo nhiều nhất (tương ứng chiếm 33,8%, 11,6% và 7,0%). Trong đó, thuốc được báo cáo nhiều nhất là cefotaxim (11,3%).
Chất lượng báo cáo nhìn chung đã cải thiện hơn so với các năm trước, tuy nhiên vẫn tồn tại các báo cáo thiếu nhiều thông tin gây khó khăn cho công tác thẩm định. Bên cạnh các ADR rối loạn toàn thân và biểu hiện trên da, cán bộ y tế cũng cần chú trọng theo dõi, phát hiện và báo cáo các biến cố bất lợi của thuốc trên các hệ cơ quan khác, các biến cố bất lợi cần giám sát thông qua các thăm dò chức năng chuyên sâu hay xét nghiệm cận lâm sàng.
Tài liệu: Tổng kết hoạt động báo cáo phản ứng có hại của thuốc năm 2015 của Trung tâm DI & ADR Quốc gia.
Các bài viết khác