20/01/2017
Nội dung: Báo cáo tổng kết ADR của 63 tỉnh thành năm 2016
I. THÔNG TIN CHUNG VỀ BÁO CÁO
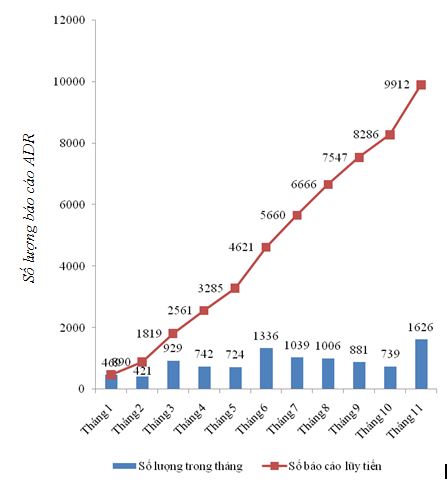
Tổng số báo cáo ADR Trung tâm DI & ADR Quốc gia và Trung tâm DI&ADR khu vực TP Hồ Chí Minh đã tiếp nhận và xử lý tính đến ngày 15/11/2016 là 9912 báo cáo (đạt 108,1 báo cáo/1 triệu dân). Tổng số báo cáo nghiêm trọng 3869 (chiếm 39% tổng số báo cáo ghi nhận được trong năm 2016).
Số lượng báo cáo năm 2016 nhận được theo từng tháng và số lượng báo cáo lũy tiến được tổng kết trong Hình 1
Hình 1: Số lượng báo cáo năm 2016 theo từng tháng
Số lượng báo cáo ADR được phân loại thành báo cáo liên quan đến phản ứng có hại của thuốc, báo cáo liên quan đến chất lượng thuốc và báo cáo liên quan đến sai sót trong sử dụng thuốc được trình bày trong Bảng 1.
Bảng 1: Phân loại báo cáo ADR
|
Số lượng báo cáo |
Tỷ lệ % (n=9912) |
|
|
Phản ứng có hại của thuốc |
9537 |
96,2 |
|
Chất lượng thuốc |
64 |
0,6 |
|
Sai sót trong sử dụng thuốc |
6 |
0,1 |
|
Khác |
305 |
3,1 |
Số lượng báo cáo liên quan đến thuốc điều trị HIV, thuốc điều trị lao, thuốc điều trị sốt rét, thuốc có nguồn gốc dược liệu/ thuốc y học cổ truyền, vắc xin và sinh phẩm y tế được tổng hợp trong Bảng 2. Trong đó, số lượng báo cáo ADR liên quan đến thuốc điều trị lao chiếm tỷ lệ cao nhất (10,3%).
Bảng 2: Tỷ lệ báo cáo liên quan đến các thuốc sử dụng trong các
chương trình mục tiêu quốc gia Y tế và thuốc có nguồn gốc dược liệu
|
Số lượng báo cáo |
Tỷ lệ % (n=9912) |
|
|
Thuốc điều trị lao |
1017 |
10,3 |
|
Thuốc điều trị HIV/AIDS |
129 |
1,3 |
|
Thuốc điều trị sốt rét |
112 |
1,1 |
|
Vắc xin và sinh phẩm y tế |
276 |
2,8 |
|
Thuốc có nguồn gốc dược liệu |
228 |
2,3 |
+ Tổng số cơ sở khám, chữa bệnh đã gửi báo cáo ADR là 767 (tăng 5,4% so với năm 2015), danh sách các đơn vị gửi nhiều báo cáo nhất được liệt kê trong bảng 6.
Bảng 3: Danh sách 10 bệnh viện gửi báo cáo nhiều nhất
|
STT |
Đơn vị gửi báo cáo |
Tỉnh |
Số báo cáo |
Tỷ lệ (%) N=8562 |
|
1 |
Bệnh viện Phạm Ngọc Thạch |
TP. Hồ Chí Minh |
371 |
4,3 |
|
2 |
Bệnh viện Từ Dũ |
TP. Hồ Chí Minh |
203 |
2,4 |
|
3 |
Bệnh viện Bạch Mai |
Hà Nội |
181 |
2,1 |
|
4 |
Bệnh viện Nhân Dân Gia Định |
TP. Hồ Chí Minh |
135 |
1,6 |
|
5 |
Bệnh viện Phổi Trung ương |
Hà Nội |
134 |
1,6 |
|
6 |
Bệnh viện Đa khoa Đà Nẵng |
Đà Nẵng |
120 |
1,4 |
|
7 |
Bệnh viện Da Liễu TP. HCM |
TP. Hồ Chí Minh |
113 |
1,3 |
|
8 |
Viện sốt rét - Ký sinh trùng - Côn trùng Trung ương |
Hà Nội |
111 |
1,3 |
|
9 |
Bệnh viện Phụ Sản - Nhi Đà Nẵng |
Đà Nẵng |
103 |
1,2 |
|
10 |
Bệnh viện Lao và Bệnh Phổi Nghệ An |
Nghệ An |
102 |
1,2 |
Với việc triển khai tích cực công tác theo dõi phản ứng có hại của thuốc, bệnh viện Phạm Ngọc Thạch, bệnh viện Từ Dũ và bệnh viện Bạch Mai đã đóng góp số lượng lớn báo cáo ADR vào cơ sở dữ liệu phản ứng có hại của thuốc trong năm 2016 (4,3%; 2,4% và 2,1%). Các bệnh viện gửi nhiều báo cáo chủ yếu tập trung ở Thành phố Hồ Chí Minh và Hà Nội. Cả nước đã có 767 đơn vị tham gia gửi báo cáo ADR trong năm 2016, bên cạnh đó, còn nhiều cơ sở khám, chữa bệnh chưa tham gia thực hiện gửi báo cáo ADR (không có trong danh sách bảng 4).
· Về chất lượng báo cáo
Đa số báo cáo gửi về ghi đầy đủ các thông tin yêu cầu gồm 4 trường thông tin chính là: thông tin người bệnh, thông tin về phản ứng có hại, thông tin về thuốc nghi ngờ và thông tin về người báo cáo. Tuy nhiên, vẫn còn một số báo cáo thông tin chưa rõ ràng, còn viết tắt và viết khó đọc gây khó khăn trong quá trình xử lý và thẩm định. Một số thông tin chưa được báo cáo hoặc được báo cáo sơ sài gây khó khăn cho thẩm định báo cáo như diễn biến ADR (sau khi ngừng thuốc, tái sử dụng thuốc (nếu có)), lý do dùng thuốc, liều dùng, …
Thông tin về người báo cáo
Bảng 4: Thông tin về đối tượng gửi báo cáo
|
Đối tượng gửi báo cáo |
Số lượng |
Tỷ lệ (%) n=8562 |
|
Dược sĩ |
3515 |
41,1 |
|
Bác sĩ – Y sĩ |
2710 |
31,7 |
|
Điều dưỡng - Nữ hộ sinh |
1683 |
19,7 |
|
Khác |
117 |
1,4 |
|
Không có thông tin |
537 |
6,3 |
|
Tổng |
8562 |
100,0 |
II. THÔNG TIN VỀ THUỐC NGHI NGỜ GÂY ADR
Trong 8566 báo cáo có 56 báo cáo về chất lượng thuốc, 2 báo cáo về sai sót điều trị và 20 báo cáo loại khác (dụng cụ y tế, mỹ phẩm, thuốc trừ sâu …), do đó thông tin về thuốc nghi ngờ được thống kê trên 8484 báo cáo, tương ứng với 10220 thuốc nghi ngờ (tỷ lệ 1,2 thuốc/1 báo cáo).
2.1. Tổng hợp phân loại báo cáo ADR theo đường dùng thuốc
Bảng 5: Tổng hợp báo cáo ADR theo đường dùng thuốc
|
STT |
Đường dùng |
Số lượng |
Tỷ lệ % (n=8556) |
|
1 |
Tiêm tĩnh mạch, truyền tĩnh mạch |
4410 |
52,0 |
|
2 |
Uống |
3450 |
40,7 |
|
3 |
Tiêm bắp |
774 |
9,1 |
|
4 |
Test da |
233 |
2,7 |
|
5 |
Thuốc đặt trực tràng |
264 |
3,1 |
|
6 |
Tiêm dưới da |
126 |
1,5 |
|
7 |
Khác |
344 |
4,1 |
|
8 |
Không có thông tin |
619 |
7,3 |
Phản ứng có hại xảy ra với hầu hết các đường dùng thuốc. Tuy nhiên, phản ứng có hại xảy ra khi dùng thuốc bằng đường tiêm truyền tĩnh mạch và đường uống chiếm tỷ lệ nhiều nhất tương ứng là 52,0% và 40,7%. Phản ứng có hại xảy ra khi dùng thuốc bằng đường tiêm bắp cũng chiếm tỷ lệ đáng kể (9,1%).
2.2. Tổng hợp phân loại các nhóm thuốc nghi ngờ gây ADR theo nhóm dược lý
Bảng 6: Các nhóm thuốc nghi ngờ gây ADR
|
Mã phân loại ATC |
Nhóm thuốc |
Số lượng |
Tỷ lệ (%) n=8484 |
|
J |
Kháng khuẩn tác dụng toàn thân |
6722 |
79,2 |
|
N |
Hệ thần kinh |
759 |
8,9 |
|
M |
Hệ cơ - xương |
691 |
8,1 |
|
B |
Máu và cơ quan tạo máu |
388 |
4,6 |
|
A |
Đường tiêu hóa và chuyển hóa |
376 |
4,4 |
|
P |
Thuốc kháng kí sinh trùng và côn trùng |
223 |
2,6 |
|
L |
Thuốc chống ung thư và điều hoà miễn dịch |
197 |
2,3 |
|
C |
Hệ tim mạch |
137 |
1,6 |
|
G |
Hệ sinh dục tiết niệu và các hormon sinh dục |
128 |
1,5 |
|
R |
Hệ hô hấp |
112 |
1,3 |
|
H |
Các chế phẩm hormon dùng đường toàn thân, trừ hormon sinh dục và insulin |
91 |
1,1 |
|
D |
Da liễu |
46 |
0,5 |
|
S |
Cơ quan cảm thụ |
32 |
0,4 |
|
V |
Các thuốc khác |
193 |
2,3 |
|
U |
Không rõ |
125 |
1,5 |
Nhóm thuốc kháng khuẩn dùng đường toàn thân là nhóm thuốc được báo cáo nhiều nhất (79,2%). Tiếp theo là nhóm thuốc tác dụng trên hệ thần kinh chiếm tỷ lệ là 8,9%, nhóm thuốc tác dụng trên hệ cơ xương chiếm tỷ lệ là 8,1%.
2.3. Nhóm dược lý được báo cáo nhiều nhất
Bảng 7: Các nhóm dược lý được báo cáo nhiều nhất
|
Mã phân loại ATC |
Nhóm thuốc |
Số lượng |
Tỷ lệ (%) n=8484 |
|
J01D |
Kháng sinh beta-lactam khác (bao gồm cephalosporin thế hệ từ 1 đến 4, carbapenem,…) |
3028 |
35,7 |
|
J04A |
Thuốc điều trị lao |
1248 |
14,7 |
|
J01M |
Kháng sinh nhóm quinolon |
668 |
7,9 |
|
J01C |
Kháng sinh nhóm beta-lactam, họ penicilin |
614 |
7,2 |
|
M01A |
Chống viêm, chống thấp khớp |
611 |
7,2 |
|
J01G |
Kháng sinh nhóm aminoglycosid |
349 |
4,1 |
|
J01X |
Kháng sinh nhóm khác (bao gồm kháng sinh nhóm glycopeptid, các polymyxin, dẫn chất 5 nitro-imidazol,…) |
268 |
3,2 |
|
N02B |
Thuốc giảm đau và hạ sốt khác |
244 |
2,9 |
|
N05A |
Thuốc chống loạn thần |
239 |
2,8 |
|
P01B |
Thuốc điều trị sốt rét |
222 |
2,6 |
Các kháng sinh nhóm beta-lactam khác (cephalosporin thế hệ từ 1 đến 4, carbapenem…) là nhóm kháng sinh có tỷ lệ báo cáo biến cố có hại nhiều nhất (35,7%). Tiếp theo là nhóm thuốc điều trị lao (14,7%) và kháng sinh nhóm quinolon (7,9%).
2.4. Thuốc nghi ngờ được báo cáo nhiều nhất
Các thuốc nghi ngờ gây ADR được báo cáo nhiều nhất được trình bày trong bảng 12.
Bảng 12: Danh sách 10 thuốc nghi ngờ được báo cáo nhiều nhất
|
STT |
Tên thuốc |
Số lượng |
Tỷ lệ (%) (n=8484) |
|
1 |
cefotaxim |
1043 |
12,3 |
|
2 |
ceftriaxon |
498 |
5,9 |
|
3 |
ceftazidim |
469 |
5,5 |
|
4 |
diclofenac |
418 |
4,9 |
|
5 |
ciprofloxacin |
375 |
4,4 |
|
6 |
ethambutol |
340 |
4,0 |
|
7 |
rifampicin/isoniazid/pyrazinamid |
291 |
3,4 |
|
8 |
amoxicilin kết hợp với chất ức chế enzym (acid clavunalic, sulbactam) |
280 |
3,3 |
|
9 |
cefuroxim |
235 |
2,8 |
|
10 |
levofloxacin |
226 |
2,7 |
Các thuốc nghi ngờ gây phản ứng có hại xuất hiện nhiều nhất trong các báo cáo ADR thuộc 3 nhóm chính: nhóm thuốc kháng sinh nhiều nhất với 7 đại diện là cefotaxim, ceftriaxon, ceftazidim, ciprofloxacin, amoxicilin kết hợp với chất ức chế enzym (acid clavulanic, sulbactam), cefuroxim và levofloxacin; nhóm thuốc điều trị lao (ethambutol, rifampicin/isoniazid/pyrazinamid) và nhóm thuốc giảm đau, hạ sốt, chống viêm (diclofenac). Cefotaxim vẫn là thuốc nghi ngờ gây ra ADR được báo cáo nhiều nhất với tỷ lệ là 12,3%.
III. KẾT LUẬN
Tính đến 15/11/2016, Trung tâm DI & ADR Quốc gia đã tiếp nhận 9912 báo cáo ADR, trung tâm đã thẩm định và phản hồi 5990 báo cáo (chiếm 60,4% tổng số báo cáo ADR). Số báo cáo ADR nghiêm trọng là 3869 báo cáo (chiếm 39% tổng số báo cáo ADR), trong đó có 46 trường hợp nghiêm trọng dẫn đến hậu quả tử vong đã được xử lý khẩn.
Chất lượng báo cáo nhìn chung đã cải thiện hơn so với các năm trước, tuy nhiên vẫn tồn tại các báo cáo thiếu nhiều thông tin gây khó khăn cho công tác thẩm định. Bên cạnh các ADR rối loạn toàn thân và biểu hiện trên da, cán bộ y tế cũng cần chú trọng theo dõi, phát hiện và báo cáo các biến cố bất lợi của thuốc trên các hệ cơ quan khác, các biến cố bất lợi cần giám sát thông qua các thăm dò chức năng chuyên sâu hay xét nghiệm cận lâm sàng.
Tài liệu: Báo cáo tổng kết công tác báo cáo phản ứng có hại của thuốc (ADR) năm 2016 của Trung tâm DI & ADR Quốc gia.
Các bài viết khác